A táplálékkészítmények biztonságosságának és tolerálhatóságának értékelése ANgelman-szindrómában (FANS) szenvedő betegeknél: vizsgálati protokoll egy randomizált, kontrollált vizsgálathoz
Absztrakt
Háttér
A ketogén és alacsony glikémiás indexű étrend hatékonyan kezeli az Angelman-szindrómában szenvedő gyermekek gyógyszerrezisztens rohamait. A megismerés, a mobilitás, az alvás és a gyomor-bélrendszer egészsége szorosan kapcsolódik a rohamok aktivitásához és az általános életminőséghez. A ketogén és alacsony glikémiás étrend korlátozza a szénhidrátfogyasztást és stabilizálja a vércukorszintet. A ketogén étrend ketózist vált ki, egy metabolikus állapotot, ahol a ketontesteket előnyösen üzemanyagként használják. Az exogén ketonok alkalmazását a ketózis elősegítésében Angelman-szindrómában korábban nem vizsgálták. Az itt értékelt vizsgálati készítmény az exogén keton-béta-hidroxi-butirátot tartalmazza, hogy a testet gyorsan a ketózis felé terelje, ami fokozott metabolikus hatékonyságot eredményez.
Módszerek/tervezés
Ez egy 16 hetes, randomizált, kettős-vak, placebo-kontrollos, crossover vizsgálat, amelynek célja az exogén ketonokat tartalmazó táplálék-összetételek biztonságosságának és tolerálhatóságának felmérése. Azt is megvizsgálja, hogy az exogén ketonok hogyan javíthatják a páciens táplálkozási állapotát, ami befolyásolhatja az Angelman-szindrómában élés fiziológiai, tüneti és egészségügyi következményeit.
Vita
Ez a kézirat felvázolja egy tanulmány indokolását, amelynek célja az volt, hogy elsőként szolgáltasson adatokat az Angelman-szindrómában szenvedő betegek táplálkozási megközelítéséről exogén ketonok alkalmazásával.
Próba regisztráció
ClinicalTrials.gov, ID: NCT03644693. 2018. augusztus 23-án regisztrálták. Utolsó frissítés: 2018. augusztus 23.
Háttér
Az Angelman-szindrómát (AS) először 1965-ben írták le [1], és az általános populációban 1: 10 000–1: 24 000 [2,3,4]. Az anya funkciójának elvesztése vagy csökkentése UBE3A gén (ubiquitin protein ligáz E3A) az 1990-es évek végén az esetek többségében ok-okozati mechanizmusként azonosították [5, 6]. Az AS-ben szenvedő betegek világszerte fejlődési késedelmekkel rendelkeznek, beleértve a beszédzavarokat és a mozgászavarokat [7]. Az egyéneket jellemzően úgy írják le, hogy boldogan és gyakran nevetve viselkednek. A betegek nyolcvan százaléka rohamot is tapasztal, és minden AS-ben szenvedő egyénnek rendezetlen elektroencefalogramja van (EEG) [8, 9]. A lakosság nagy részének táplálkozási problémái (75%) és egyéb emésztőrendszeri (GI) panaszai is vannak [7, 10]. Sajnos az AS-nek nincs gyógymódja. A tipikus kezelési protokollok közé tartozik a rohamok gyógyszeres terápiája, a fizikai és viselkedési terápiák, valamint az oktatási beavatkozások. Az AS populáció hozzávetőlegesen 77% -a azonban kezelési rezisztens rohamokat tapasztal [8].
A refrakter epilepsziát sikeresen kezelték speciális étrendi megközelítésekkel, például ketogén (KD), közepes láncú triglicerid (MCT) és alacsony glikémiás indexű diétákkal (LGIT); ezek az étrendek sikeresek voltak az AS-ben is [12,13,14,15]. A KD lehetővé teszi a test számára a szénhidrát alapú anyagcseréről a zsír alapú anyagcserére való áttérést, ezáltal serkenti a máj ketogenezisét. A táplálkozási ketózis olyan állapot, amikor a ketontestek vérszintje jelentősen meghaladja az alapvonalat, jellemzően> 0,5 mmol/l. A ketontestek (acetoacetát és béta-hidroxi-butirát (BHB)) a mitokondriumok által az adenozin-trifoszfát előállítására használt energiaszubsztrátok, és az agy, a szív és a vázizmok alternatív üzemanyagként használhatók a glükóz számára.
A magas refrakter rohamok, táplálkozási és GI problémák, valamint az AS súlyos kommunikációs zavarai magas kielégítetlen orvosi szükséglethez vezetnek. Súlyos kihívások állnak fenn a megfelelő étrend biztosítása érdekében, amelyek kielégítik az AS-ben szenvedő egyének összetett igényeit. Az olyan táplálkozási megközelítések, amelyek elősegítik a ketonok alternatív üzemanyagként való használatát, javíthatják az általános táplálkozási állapotot, és liberalizált étrendi terápiás stratégiát tehetnek lehetővé AS-ban szenvedő betegeknél, és ezáltal javíthatják az életminőséget.
Feltételezzük, hogy a ketogén összetevőkkel kiegészített étrend-kiegészítés fontos hatással van az AS-ben szenvedő betegek táplálkozási ketózisának kielégítésére. A keton-kiegészítők segíthetnek a ketózis elérésében és fenntartásában, javíthatják a beteg általános táplálkozási egészségét az AS tünetek kezelésében, és javíthatják a betegek és családjaik életminőségét. Ezt a vizsgálatot úgy tervezték, hogy elsőként értékelje a ketogén béta-hidroxi-butirát összetevő biztonságosságát és tolerálhatóságát magas refrakter epilepsziában szenvedő betegek körében. Ez a kézirat leírja az AS-ben szenvedő gyermekeknél a keton alapú táplálkozási beavatkozások indoklását, módszereit és lehetséges fontosságát.
Célkitűzések
A vizsgálat elsődleges célja a BHB-t tartalmazó táplálkozási készítmény tolerálhatóságának értékelése 4–11 éves AS-ban szenvedő, különböző étrendi háttérrel rendelkező betegeknél. A másodlagos célkitűzések közé tartozik a ketózis értékelése a táplálék-összetétel elfogyasztása során és a táplálék-készítmény biztonságossága AS-ben szenvedő betegeknél. Ezeket az eredménymérőket választották, mivel ez egy kiszolgáltatott, nem verbális populáció, amely korlátozottan képes kommunikálni a nehézségeket az elviselhetőség és a biztonság szempontjából. Ezenkívül az elért ketózis mértéke felhasználhatja a jövőbeni vizsgálatokat a betegek táplálkozási állapotának az egészségügyi eredményekre gyakorolt jótékony hatásának felmérésére. Valamennyi intézkedést kiértékeljük a kiinduláskor és minden 4 hetes intervenciós periódus végén (placebo vs. tesztformula).
Módszerek/tervezés
Népesség és beállítás
A vizsgálat további felügyeletét és ellenőrzését Donna Herber, PhD, a Disruptive Nutrition, LLC tudományos igazgatója biztosítja, heti konferenciákkal a Vanderbilt kutatócsoport tagjaival. A személyes megbeszéléseket negyedévente tervezik, az adatellenőrzést félévente. Létrehoztak egy orvosi és kutatási tanácsadó bizottságot, amely független szakértőkből és legfontosabb véleményvezérekből áll. A bizottság félévente ülésezik. Az Adatbiztonsági Megfigyelő Testületet ennek a protokollnak az „Adatmegfigyelés” szakaszának külön szakaszában tárgyaljuk.
A betegeket a Vanderbilt Egyetem tennessee-i Nashville-i telephelyére toborozzák. Az AS-ben szenvedő alanyokat a vezető nyomozói gyakorlat, az orvos-beutalások, a közösségi médián keresztüli tájékoztatás és az olyan szülői támogató csoportok toborozzák, mint az Angelmani Szindróma Terápiás Alapítványa és az Angelmani Szindróma Alapítvány. Az alanyok felvétele a következő felvételi kritériumok szerint történik: az Angelman-szindróma genetikailag igazolt diagnózisa; életkor 4–11 év; jelenleg LGIT, KD (hagyományos 4: 1 vagy 3: 1, MCT, módosított Atkins) vagy szokásos étrend (rendszeres étrend) mellett folyamatosan, legalább 3 hónapig; hajlandóság a vizsgálati készítmény fogyasztására; és hajlandóság otthoni és klinikai látogatások protokollvizsgálatainak elvégzésére. Az alanyokat kizárjuk, ha: parenterális táplálást igényelnek; súlyos máj- vagy veseműködése van; kórtörténetében cukorbetegség van vagy cukorbetegségben szenved; testtömegindexével jelentősen alulsúlyosak. 1
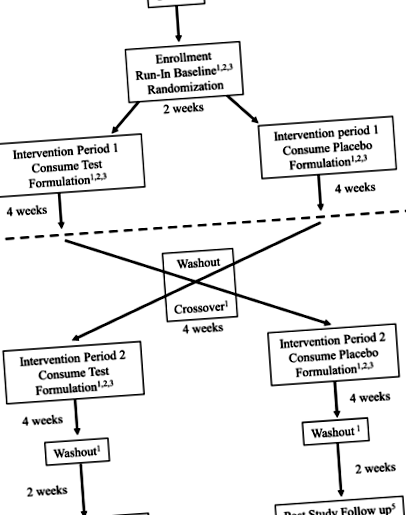
FANS próba tervezése - randomizált, placebo-kontrollos, crossover vizsgálat. Szabványos protokolltételek: Ajánlások az intervenciós vizsgálatokhoz (SPIRIT) ábra; a beiratkozás ütemezése, beavatkozások és értékelések. * Telefonon vagy személyesen a klinika helyszínén végezhető. ** Az alaplátogatás során további vérmintát gyűjtünk, és hozzáadjuk a tárolóhoz. A mintákat fel lehet használni olyan vizsgálatokhoz, mint a DNS és RNS, a proteomika és a metabolomika, és fel lehet használni kiegészítő vizsgálatokhoz, amelyek nem kapcsolódnak a jelenlegi kísérlethez. A publikálás idején más tanulmányokat nem terveztek
Ennek a táplálkozási beavatkozási protokollnak a vizsgálata egy randomizált, kettős-vak, placebo-kontrollos, keresztezett vizsgálat. A vizsgálatnak két ága van: (1) egy vizsgálati készítmény-periódus, amelyet egy placebo-készítmény-periódus követ, vagy (2) egy placebo-formulációs periódus, amelyet egy vizsgálati készítmény-periódus követ. Minden beteg megkapja mind a vizsgálati készítményt, mind a placebo készítményt, mindkét kar között kimosási periódussal. A randomizációs ütemtervet az Investigational Drug Service Pharmacy hozta létre randomizáló szoftver alkalmazásával, 1: 1 arányban, 4 blokkmérettel. A résztvevőket a randomizációs táblázat következő nyílt nyílásába vonták be. A tápanyag-összetételeket a gyártó tételszáma kódolja, ezért a klinikai személyzet vak a tartály tényleges tartalmával szemben (aktív versek placebo).
Miután randomizálták, az alanyok megkezdik az 1. intervenciós periódust, egy 4 hetes időszakot, amelyben BHB-t vagy placebót tartalmazó táplálkozási készítményt kapnak, miközben megtartják a tanulmány bejáratánál feljegyzett étrendet. Az otthoni megfigyelés az ábra szerint történik. 1. Négy hetes vak beavatkozás után az alanyokat kiértékelik a klinikán, majd egy 4 hetes mosási periódus alatt beszüntetik a ketonkészítmény vagy a placebo fogyasztását. A kimosás befejezése után az alanyok egy második 4 hetes periódusba lépnek, amelyben kapják a készítményt a placebóval szemben. A vizsgálat teljes időtartama alatt folytatják az otthoni ellenőrzést. Ezt követően, a második beavatkozás befejeztével, átesnek az utolsó tervezett tanulmányi látogatáson és laboratóriumi mintavételen. A 2. beavatkozási periódust egy lemosási időszak követi, és körülbelül a vizsgálat 16. hetében utólagos felhívást intéznek a családhoz, hogy vizsgálják felül a tüneteket és biztosítsák, hogy a beteg ebben az időszakban ne tapasztaljon káros eseményeket. A beiratkozás, a beavatkozások és az értékelések próbaütemezését a 2. és 7. ábra szemlélteti. 1 (a ventilátorok vizsgálati ütemezése).
Eljárások és beavatkozások
Az elviselhetőséget minden 4 hetes beavatkozási időszak végén határozzák meg. A protokoll betartását mind a vizsgálati, mind a placebo beavatkozási periódus alatt ellenőrzik az elfogyasztott készítmény mennyiségének feljegyzésével. A készítmények elfogadhatóságát az egyes beavatkozási időszakok végén egy szülői kérdőív értékeli, értékelve a táplálékkészítmény kényelmét, ízét és elfogadhatóságának mértékét 10 pontos Likert-skálán vagy a vizsgálati protokollnak való megfelelés és a készítmény háromszoros fogyasztása alapján. napi konzisztencia a 4 hetes intervenciós periódus alatt. Hasonló rangsorolási rendszereket alkalmaztak a készítmények elfogadhatóságának értékelésére más táplálkozási beavatkozásokkal az epilepsziás populációkban is [22,23,24,25].
A biztonságot a protokoll teljes időtartama alatt értékelik (1) a nemkívánatos események bejelentésével és (2) a protokoll során összegyűjtött klinikai paraméterek értékelésével, beleértve az antropometriát, a vér anyagcsere profilját, az étrendi bevitelt, a rohamok gyakoriságát, az EEG-t, az ERP-t, a mobilitást, a GI funkciót és alvási szokások. Ebben a populációban szorosan figyelemmel kell kísérni a beavatkozás negatív hatásainak lehetőségét, mivel a betegek nonverbálisak. A 4. kiegészítő fájl tartalmazza a kikért és spontán jelentett nemkívánatos események összegyűjtésének, értékelésének, jelentésének és kezelésének részleteit.
A vizsgálati és a placebo készítményeket az alany testtömegének megfelelő adagmérettel adják be. A vizsgálati készítmény 100 kcal-ra béta-hidroxi-butirátot, 2 g szénhidrátot, 1 g fehérjét és 9 g zsírt, valamint ásványi anyagokat tartalmaz. A placebo csak ásványianyag-tartalomra vonatkozik. A tápszert naponta háromszor adják szájon át ételként vagy italként.
Statisztikai szempontok
A vizsgálat elsődleges eredménye a BHB-t tartalmazó táplálkozási készítmény tolerálhatóságának értékelése AS-ban szenvedő betegeknél. Az elviselhetőséget annak bizonyítja, hogy a beteg betartja a protokollt, amelyet az elfogyasztott készítmény mennyisége határoz meg az előírt mennyiséghez viszonyítva, és az egyes beavatkozási időszakok végén értékelik. A táplálékkészítmény család általi idő előtti abbahagyása szintén potenciális intoleranciának számít. A tolerálhatóságot minden egyes beavatkozási időszak végén felmérik egy szülői kérdőív segítségével is. Ezeket az eredménymérőket választották, mivel ez egy kiszolgáltatott, nem verbális populáció, korlátozott kommunikációs képességgel, ezért megfelelő első lépés annak meghatározása, hogy a készítmény megfelelő-e és jól tolerálható-e.
A másodlagos eredmények közé tartozik a ketózis értékelése a táplálék-összetétel fogyasztásakor és a táplálék-készítmény biztonságossága AS-ben szenvedő betegeknél. A ketózist naponta értékelik vizeletvizsgálattal, valamint vérvizsgálattal az egyes beavatkozási időszakok végén. A ketózis mértéke és időzítése klinikailag releváns lehet a beteg jobb táplálkozásának bemutatásához, mivel a táplálkozási ketózis összefüggésben áll a beteg jobb eredményeivel, amint ezt a kézirat hátterében leírják. A biztonságot a motoros funkciók, a kognitív funkciók, a GI-tolerancia, az alvás és a görcsrohamok változásával, valamint a magasság, a súly és a vér metabolikus paneljeinek változásával értékelik, az egyes beavatkozási időszakok végén értékelve. Ezenkívül a nem kívánt események jelentését valós időben figyelemmel kíséri a vizsgálat koordinátora.
Nincs olyan vizsgálat, amely tesztelné keton kiegészítést AS-ben szenvedő betegeknél. Ezért a minta méretének becslése a ketózis mértékein alapul. Egér preklinikai vizsgálatokból, MCT és/vagy BHB-t alkalmazó nem AS klinikai vizsgálatokból és alacsony szénhidráttartalmú étrendi beavatkozásokból feltételezik, hogy a másodlagos kimenetel, a ketózis mértékének minimális változása az alapvonaltól a végéig a vizsgálati formuláció intervenciós periódusának negyedik hete 100% -os változás lesz a kiindulási értékhez képest (a standard étrend alapvonala általában
Vita
Az Angelman-szindrómát refrakter epilepszia jellemzi. Valójában az AS-ben szenvedő betegek EEG-e rendellenességek a neurotípusos kontrollokkal összehasonlítva, még rohamok nélkül is [26]. A koplalást az ókortól kezdve felismerték a rohamok lehetséges kezelésében, és az 1920-as évek elején bevezették a koplalást utánzó étrendi beavatkozást [27, 28]. Ezek a diéták táplálkozási metabolikus ketózis állapotba hozzák a testet. A táplálkozási ketózist modellként alkalmazva számos étrendi beavatkozást vizsgáltak mind állatmodellekben, mind humán klinikai vizsgálatokban különféle neurológiai rendellenességek esetén.
A refrakter epilepsziában szenvedő gyermekek számára a táplálkozási ketózishoz vezető diétás beavatkozások hatékonyak és biztonságosak. A módosított Atkin-étrend, amelyet prospektív módon 3–18 éves gyermekeknél vizsgáltak, kimutatta, hogy a mérsékelt vizelet-ketózis 4 napon belül kialakult, a rohamok gyakorisága jelentősen javult a 6. hónapban [29]. Az AS-ben az esettanulmányok is bizonyítják a hatékonyságot [30]. A hármas antikonvulzív terápiának ellenálló, kontrollálhatatlan napi rohamokkal rendelkező 5 éves lány esetében a KD hatékonynak bizonyult a rohamok csökkentésében a kezelés kezdetének első hetétől kezdve. Epilepsziás aktivitás nélküli EEG megerősítette a beteg javulását, az alvás és a hiperaktivitás javulásával együtt. Egy AS-ben szenvedő betegek külön vizsgálatában a 4 hónapos LGIT csökkentette a rohamok gyakoriságát, korrelatív javulással a vizsgálat utáni EEG mellett, a fejlődés előrehaladásának bizonyítékával. Az étrendet jól tolerálták, és hat alany közül öt maradt az LGIT-en a vizsgálat befejezése után [14]. Az LGIT-t alkalmazó 23 AS-ban szenvedő beteg retrospektív orvosi felmérése azt sugallta, hogy az alanyok 22% -a fenntartotta a teljes rohamszabadságot, 43% -uk a rohamszabadságot, kivéve a betegség vagy a nem görcsös epilepticus állapotát, és 30% -uknál csökkent a roham frekvencia [13].
Az irodalom biztonságos átmenetet javasol a glükózból a ketontestekbe üzemanyagként. Az LGIT diéta gyermekkori epilepsziában történő alkalmazásának átfogó vizsgálata korlátozott mellékhatásokat és csökkent rohamok gyakoriságát mutatta ki [31]. Az MCT diéta tanulmányai a GI panaszokat tárták fel a legnagyobb tolerálhatósági kérdésként [32]. Acidosisról is beszámoltak. A gyermekek táplálkozási hiányának kockázata a korlátozó étrendi kezeléseknél és a KD-specifikus kiegészítők hiánya aggályokat vetett fel a mikroelemek állapotával kapcsolatban. A KD-vel kezelt, kezelhetetlen epilepsziában szenvedő gyermekeknél megmérték az A- és E-vitamin, a cink, a szelén, a kalcium és a magnézium szintjét [33]. A kutatók szerint a plazma A- és E-vitamin-változások és a magnézium-állapot 12 hónap utáni csökkenése nem optimális lehet, és további megközelítést igényelhet a KD-hez.
Az állati bizonyítékok, amelyek alátámasztják a ketonpótlást, illetve a KD-k klinikai bizonyítékai az AS modellekben és a rohamkontrollban, arra utalnak, hogy az exogén ketonokat tartalmazó étrendi beavatkozások fontos fejleményeket jelenthetnek a klinikai kezelési stratégiákban. A jelenlegi tanulmány a különféle étrendi háttérrel alkalmazott ketogén készítmények kezdeti értékelésének célja. Egyedülálló lehetőséget jelent a táplálkozási beavatkozás lehetséges előnyeinek tanulmányozására AS-ban szenvedő gyermekpopulációban (4–11 évesek). A tanulmányból nyert ismeretek további értékeléseket teremthetnek az exogén ketonok táplálkozási stratégiákban való alkalmazásának a betegek étrendi kezelésében.
Az AS populációban ismert, hogy nagy a placebo hatás. Tanulmányunk egyedülálló kialakítást is kínál, amelyben az objektív intézkedések használatát helyezik előtérbe. Reméljük, hogy ez olyan intézkedéseket hoz, amelyek előnyösek lesznek az Angelman közösség jövőbeni kísérletei mellett a BHB ketózis kiváltására irányuló általános hatékonyságának és hatásmechanizmusának tisztább megértése mellett. A végső cél a táplálkozási állapot pozitív befolyásolása lesz, amelynek javítania kell a beteg azon képességét, hogy legyőzze az AS tüneteit, például rohamokat, megismerést és tanulást, járást/mozgékonyságot és/vagy alvászavarokat.
Próba állapota
ClinicalTrials.gov, ID: NCT03644693. 2018. augusztus 23-án regisztrálták. Utolsó frissítés: 2018. augusztus 23 .; toborzás kezdete: 2018. november; becsült befejezési dátum 2019. december.
Az adatok és anyagok rendelkezésre állása
Az adatmegosztás nem alkalmazható erre a cikkre, mivel a jelenlegi vizsgálat során nem hoztak létre és nem elemeztek adatkészleteket. A fő kutató és a klinikai csoport hozzáfér a végső adatkészlethez. A zavaró táplálkozás kutatócsoportja csak az azonosítatlan adatokhoz férhet hozzá.
- A banánból főzött elválasztott ételek elkészítése és táplálkozási értékelése, kiegészítve
- Élelmiszer - gyakorisági kérdőív (FFQ) megtervezése és validálása az élelmiszer táplálkozási értékeléséhez
- A tavirózsa (Nymphaea lotus Linn
- Kérdőív értékelése a thaiföldi táplálkozási ismeretek, attitűdök és gyakorlatok értékelésére
- Konvertálja a BTU-t Cal British termikus egységgé kalória táplálékká