A testmozgás gyengíti a vázizomzatban az éhgyomorra kiváltott metabolikus gének transzkripciós aktivációját
A John B. Pierce laboratórium,
A John B. Pierce laboratórium,
Sejt- és Molekuláris Élettani Tanszék, Yale Egyetem Orvostudományi Kar, New Haven, Connecticut 06519
Absztrakt
Az éhezés a lipid metabolizmus fokozatos növekedését váltja ki a vázizomban. Az éhezés hatásainak meghatározása a metabolikus szabályozás szempontjából fontos gének transzkripciós szabályozására a különböző rosttípusokból álló vázizomzatban, a kontroll és az éheztetett (24 és 72 órás) patkányok magjaiban RT-PCR alkalmazásával nukleáris futóanalízisnek vetettük alá. alapú technika. A koplalás megnövekedett (P a vázizom tömegének és teljes energiaigényének köszönhetően az elsődleges szövet, amely felelős az étrendi glükóz és lipidek keringésből történő eltávolításáért, és ezért kulcsszerepet játszik az általános metabolikus homeosztázis fenntartásában (33, 42). Az a növekvő felismerés, hogy az energiaegyensúly finom változásai, ha hosszabb időn át mérlegelik, jelentős kockázati tényezőt jelent az olyan anyagcsere-rendellenességek kialakulásában, mint az inzulinrezisztencia, a hipertrigliceridémia, az elhízás és az inzulinfüggő diabetes mellitus, fokozta a keresést specifikus sejtjelző és szabályozó fehérjékhez, amelyek befolyásolhatják a csontvázizomzat metabolikus szabályozását (32).
A legtöbb előrelépés annak megértésében, hogy miként érzékelhetők és reagálhatnak molekuláris szinten a közbenső anyagcsere akut kihívásai, a májban, a vesében és a zsírszövetben végzett munkából származnak. Például a táplált állapotból az éheztetett állapotba való átmenet drámai módon aktiválja számos enzimet kódoló gén transzkripcióját, amelynek sebességkorlátozó szerepe van a máj glükoneogenezisében, a zsírsav oxidációjában és a ketogenezisben. A transzgénikus egereken végzett molekuláris vizsgálatok és a különféle sejttenyésztési rendszerek segítségével a szabályozó elemek részletes jellemzése e gének promóter régióiban a kulcsfontosságú szignálfehérjék és transzkripciós faktorok azonosításához vezetett, amelyek reagálnak a különböző táplálkozási és/vagy hormonális manipulációkra (13, 19.30).
Anyagok.
A hím Sprague-Dawley patkányokat házon belül tenyésztették, vagy a Charles River Laboratory-ból (Wilmington, MA) vásárolták. Valamennyi patkányt külön-külön tartottuk hőmérsékleten (22 ° C) és fénytől vezérelt helyiségben (sötét 9: 00–21: 00), és szabad hozzáférést kaptak az élelemhez (Purina Rodent Diet) és a vízhez. Rádiójelekkel ellátott vegyületeket az Amersham Pharmacia Biotech cégtől vásároltunk. Minden más vegyi anyag molekuláris biológiai minőségű volt, és a Boehringer Mannheim, a GIBCO-BRL, a Promega vagy a Sigma Chemical cégtől vásárolták őket.
Kísérleti terv.
A patkányok minden kísérlet idején 340–360 g tömegűek voltak. Az ételt eltávolították a kísérleti patkányoktól a sötét ciklus kezdetén (9:00), és 24 vagy 72 órán át visszatartották, miközben fenntartották a vízhez való szabad hozzáférést. A kontroll patkányok továbbra is szabadon hozzáférhettek az élelemhez és a vízhez. A második kísérletsorozatban a böjt (24 óra) során megnőtt az anyagcsere igény azáltal, hogy a patkányok két 2 órás futópadot hajtottak végre (18 m/perc, 5 ° lejtés), az étel eltávolítása után 1 és 6 órával, 10: 00:00 és 15:00). A patkányokat a 24 órás jelzésnél (~ 16 órával az utolsó edzés után) leöltük, és összehasonlítottuk további kontroll és 24 órás éhgyomri patkányokkal. A kísérletek befejeztével a patkányokat altattuk (35 mg/kg ip-pentobarbitál-nátrium), és melegítő párnára helyeztük a testhőmérséklet fenntartása érdekében a műtét során.
Atommagok szigetelése.
A transzkripció sebességének meghatározása RT-PCR-rel.
A kialakuló RNS RT-jét a Superscript II RNase H - rendszer (GIBCO-BRL) alkalmazásával, a gyártó utasításainak megfelelően végeztük. Röviden: 18 μl RNS-t összekevertünk 1,5 μl oligóval (dT) 12–18 (500 ng/μl), 10 percig 70 ° C-ra melegítettük, és 5 percig jégen hűtöttük. A kondenzáció leforgatása után 6 μl 5x reakciópuffert (250 mM Tris, pH 8,3, 375 mM KCl és 15 mM NaCl), 3 μl 0,1 M DTT-t és 1,5 μl dNTP-keveréket (egyenként 10 mM dATP, dCTP, dGTP és dTTP) minden mintához hozzáadtuk. 2 perces, 42 ° C-on történő inkubálás után 1,0 μl Superscript II-t adtunk hozzá, és a mintákat 42 ° C-on inkubáltuk 50 percig. Az enzimet 15 percig 70 ° C-on inkubálva inaktiváltuk. A futási reakció előtti minták közötti magtartalom-különbségek figyelembevétele érdekében az RT-termékeket nukleázmentes H2O-val hígítottuk az egyes sejtmag-készítmények relatív genomi DNS-tartalma alapján (lásd alább). Az átlagos térfogatot 150 μl-re állítottuk be.
1. táblázat: A nukleáris RT-RNS PCR-jéhez használt primerek és reakciókörülmények
UCP3, a 3. protein szétkapcsolása; LPL, lipáz lipoprotein; CPT I, karnitin-palmitoil-transzferáz I; LCAD, hosszú láncú acil-CoA dehidrogenáz; MCAD, közepes láncú acil-CoA dehidrogenáz; HK II, hexokináz II; [MgCl2], MgCl2 koncentráció; AT, hőkezelési hőmérséklet.
A genomi DNS izolálása és mennyiségi meghatározása.
A minták közötti magtartalom kezdeti eltéréseinek korrigálása érdekében az egyes magminták egy részéből genomiális DNS-t izoláltak a nukleáris befutási reakcióval egy napon. Egy 20 μl-es alikvot részt helyeztünk 380 μl emésztési pufferbe (10 mM Tris, pH 8,0, 100 mM NaCl, 25 mM EDTA, 0,5% SDS és 100 μg K-protein) és 50 ° C-on inkubáltuk ( 6 óra. További 380 μl nukleázmentes H2O hozzáadása után a DNS-t azonos térfogatú fenol-kloroform-izoamil-OH (25: 24: 1) extrakcióval izoláltuk, majd centrifugálással elválasztottuk (12 000). g, 4 ° C), és a kapott vizes fázisból 1 10 térfogat 3 M NaOAc -, 100 μg tRNS (a DNS-pellet vizualizálásának elősegítése céljából) és 2,5 térfogat 100% -os etanol hozzáadásával kicsapódik. A DNS-t pelletáltuk (12 000g, 10 percig, 4 ° C-on), 70% EtOH-val öblítjük, és 50 μl 10 mM Tris-ben és 1 mM EDTA-ban (TE, pH 8,0) egy éjszakán át 4 ° C-on szuszpendáljuk. A genomi DNS relatív mennyiségi meghatározását (kezdeti magtartalom) a β-aktin gén PCR-amplifikációjával határoztuk meg. Ezeket az adatokat felhasználták a mag RT-reakcióinak megfelelő RT reakciótermékeinek végső hígításainak beállításához (PCR előtt, lásd fent), hogy figyelembe vegyék a minták kezdeti magtartalmának kis különbségeit.
A teljes transzkripciós aktivitás meghatározása.
A koplalás hatása a teljes transzkripciós aktivitásra.
Az éhezés potenciális hatásának meghatározása a vázizomzat teljes transzkripciós aktivitására az egyes minták egy részének magját egy atomfutási reakciónak vetették alá, amelyben a hideg UTP-t [32P] UTP-vel helyettesítették. A teljes transzkripciós aktivitás indexeként az izolált magfuttatott RNS genomiális DNS-re normalizált teljes radioaktivitását vettük. Amint az a 2. ábrán látható. A 2. ábrán a koplalás jelentősen, 20–53% -kal csökkentette a teljes transzkripciós aktivitást a plantaris és a fehér gastrocnemius izmokban. A csökkenés az első 24 órában nyilvánvaló volt, és 72 óra elteltével nem csökkent tovább. Bár a válaszok kissé változóak voltak, a böjt is hajlamos volt (P = 0,051) a vörös gastrocnemius izom teljes transzkripciós aktivitásának csökkentése érdekében. A koplalás nem befolyásolta az egyetlen izom teljes transzkripciós aktivitását. 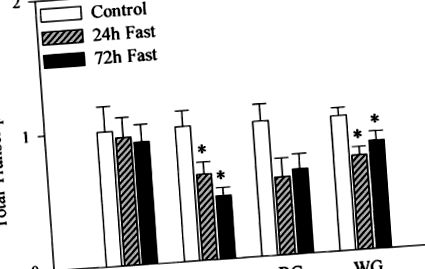
ÁBRA. 2.A kontroll és 24 és 72 órás éhgyomri patkányok vázizmainak teljes transzkripciós aktivitása. A soleus (Sol), a plantaris (PL), valamint a vörös (RG) és a fehér gastrocnemius (WG) izomból izolált sejtmagok alikvot részeit magfuttatási elemzésnek vetettük alá [32P] UTP jelenlétében, az anyagokban és módszerekben leírtak szerint. . A teljes RNS-transzkriptum képződését folyadék szcintillációs spektrometriával határoztuk meg, normalizáltuk a genomi DNS-tartalomra, figyelembe véve az atommag-tartalom változását, és a kontrollokhoz viszonyítva fejeztük ki. Az értékek átlag ± SE. * Szignifikánsan (P
A β-aktin gén átlagos transzkripciós aránya, amelyet RT-PCR magfuttatási elemzéssel határoztak meg, szintén csökkent a koplalással a plantarisban (6,7–14,7%), a vörös gastrocnemiusban (27–32%) és a fehér gastrocnemiusban (43– 50%, P
ÁBRA. 3.A kontroll, 24 órás és 72 órás éhgyomri patkányok jelzett izmaiból izolált sejtmagok magfuttatási elemzése. Az ábrán az RT-PCR-alapú magfutásanalízissel előállított negatív kép látható (festett etidium-bromiddal), amely a protein-3 (UCP3), a lipaprotein-lipáz (LPL), az izomkarnitin szétkapcsolásának génjeinek relatív transzkripciós sebességét mutatja. palmitoiltranszferáz I (CPT I), hosszú láncú acil-CoA dehidrogenáz (LCAD), közepes láncú acil-CoA dehidrogenáz (MCAD), hexokináz II (HKII) és β-aktin (β-A). Az alábbiakban bemutatjuk az egyes gének elemzését izomonként egyetlen mintakészletre vonatkozóan.
ÁBRA. 4.Ábrán ábrázolt böjtölés okozta transzkripciós arány változásainak számszerűségi adatai. 3. A kép és a statisztikai elemzés összefoglalása (n = 9–14 patkány/csoport) a jelzett (a 3. ábrán definiált) gének transzkripciós sebességének változásai a kontroll, PL 24, RG és WG izmokban, 24 órás éhezésben és 72 órás éhezésben patkányok. Az összes adatot β-aktinná normalizáltuk, és a kontrollokhoz viszonyítva (1,0-re állítva) átlagként ± SE-ként fejeztük ki. Ne feledje, hogy az átírás nagy változásai miatt a y-Az UCP3 tengelye nagyobb, mint az összes többi géné. * Szignifikánsan (P
Az éhezés metabolikus kihívásként történő alkalmazásával a jelen tanulmány célja az volt, hogy tesztelje azt a hipotézist, miszerint a vázizomzatban a zsírsavak iránti megnövekedett igény és/vagy ellátás adaptív választ vált ki, amely magában foglalja a a zsírsavak transzportjához és oxidációjához szükséges fehérjék. Ennek a hipotézisnek az alátámasztására az LPL, a CPT I és az LCAD gének transzkripciós aránya szignifikánsan 1,7–2,0-szoros, 2,1–3,0-szoros, illetve 1,7–3,7-szeresére nőtt a 24–4 72 óra koplalás (4. ábra). Nem találtunk különbséget a 24 és 72 órás éhgyomri patkányok között. Az LCAD-hez képest az MCAD gén transzkripciós sebességének változásai nem voltak olyan drámai, vagy nem voltak összhangban a szignifikáns (2,0 - 2,3-szoros) aktivációval, amely csak a fehér gastrocnemius izomban nyilvánult meg. A koplalás nem befolyásolta az LPL, a CPT I, az LCAD vagy az MCAD gének transzkripciós sebességét az egyetlen izomban. A zsíranyagcsere gének összehasonlításaként a hexokinase II gén transzkripciós sebességét is meghatározták, és azt találták, hogy szignifikánsan csak 72 órás koplalás után nőtt a soleusban (2,0-szeres), a vörös gastrocnemiusban (1,8-szoros), és fehér gastrocnemius (1,5-szeres) izmok.
A megnövekedett metabolikus igény hatása a transzkripciós szabályozásra a koplalás alatt.
ÁBRA. 5.A jelzett kontroll izmokból izolált, 24 órás éhezéses (F) vagy 24 órás éhezéses + gyakorlott magok magfutásos elemzése (FE; 2 × 2 órás futópad edzés az első 8 órában) ) patkányok. Az ábrán az RT-PCR alapú magfuttatási elemzéssel előállított (festett etídium-bromid festett) negatív kép látható, amely a jelzett gének relatív transzkripciós sebességét reprezentálja (a 3. ábrán definiálva). Az egyes gének elemzését izomonként egyetlen mintakészletre mutatjuk be.
ÁBRA. 6.A növekvő metabolikus igény a transzkripciós válaszokra 24 órás éhgyomorra. A kép és a statisztikai elemzés összefoglalása (n = 6–14 patkány/csoport). A transzkripció sebességének változásai 5 a jelzett (a 3. ábrán definiált) gének esetében a fastus (24 h) vagy az éheztetett (24 h) + gyakorolt (2 × 2-h rohamok) soleus, PL, RG és WG izomzatában futópad gyakorlat a kezdeti 8 h) patkányok során. Az összes adatot β-aktinná normalizáltuk, és a kontrollokhoz viszonyítva (1,0-re állítottuk, az adatokat nem ábrázoltuk) átlagként ± SE-ként fejeztük ki. Ne feledje, hogy az átírás nagy változásai miatt ay-Az UCP3 tengelye nagyobb, mint az összes többi géné. * Szignifikánsan (P
Jelen tanulmány elsődleges célja annak a hipotézisnek a tesztelése volt, hogy a csontvázizom súlyos metabolikus kihívása, például az éhezés, koordináta-adaptív választ vált ki a szubsztrát metabolizmusában kritikus szerepet játszó gének transzkripciós szabályozásában. Jelen tanulmány eredményei azt mutatják, hogy az éhezés számos metabolikusan rokon gén transzkripciós sebességének koordinátanövekedését idézi elő, különösen a gyorsan rángatózó vázizomzatban. A válaszok közül a legfontosabb az UCP3 gén transzkripciós arányának drámai növekedése volt a plantaris, a vörös gastrocnemius és a fehér gastrocnemius izmokban 24 órán belül az étel eltávolítása után. Az éhgyomorra reagálva számos lipid metabolizmusához szükséges gén transzkripciós aktiválása is bekövetkezett, ami közös szabályozási mechanizmusra utal. Meglepő módon azonban az élelmiszer-eltávolítást követő első órákban végzett testmozgás által okozott hozzáadott anyagcsere-igény valóban gyengítette a transzkripciós aktivációt, amelyet csak a 24 órás éhgyomorra találtak, ami ellentétes szabályozási mechanizmusok jelenlétére utal.
A patkányok egyetlen izma elsősorban lassan rángató szálakból áll, amelyek nagymértékben támaszkodnak az oxidatív anyagcserére. Kimutatták, hogy az LPL mRNS ~ 50% -kal növekszik az egyetlen izomban 1 nap böjt után (21). Ezzel szemben a jelen vizsgálatban az LPL transzkripció aránya nem változott a soleus izomban, ami arra utal, hogy az elsősorban lassan rángatós oxidatív szálakból álló izomban végzett koplalás által kiváltott LPL expresszió változásai posttranszkripciós kontroll mechanizmusokat tartalmazhatnak.
Összefoglalva, a jelen tanulmány eredményei azt mutatják, hogy a böjt az UCP3 gén transzkripciójának jelentős növekedését és a lipid metabolizmushoz szükséges számos gén transzkripciójának koordinátás növekedését váltja ki a gyorsan rángatózó vörös és fehér vázizomban, ami valószínűleg a megnövekedett bízhatóságot tükrözi. az izom éhezés során a zsírsav anyagcseréjén. Meglepő módon azonban a csontvázizomzat metabolikus igényének növelése a 24 órás böjt kezdeti 8 órájában jelentősen gyengíti a vörös vázizom lipidanyagcseréjéhez kapcsolódó számos metabolikus gén transzkripciós aktiválódását, felvetve annak lehetőségét, hogy a koplalás és a testmozgás ellenkezőt válthat ki szabályozási mechanizmusok.
Köszönjük Dr. Henritte Pilegaard és David Cameron-Smith hasznos beszélgetésekért és a kézirat áttekintéséért.
LÁBJEGYZETEK
Ezt a munkát a Yale Diabetes Endokrinológiai Kutatóközpont és az Országos Arthritis, valamint a mozgásszervi és bőrbetegségek intézete támogatásával támogatták AR-45372.
A cikk megjelenésének költségeit részben az oldaldíjak megfizetése fedezte. A cikket ezért ezennel fel kell tüntetni:hirdetés”A 18 U.S.C. 1734. § kizárólag ennek a ténynek a feltüntetésére.
HIVATKOZÁSOK
SZERZŐ MEGJEGYZÉSEK
Az újranyomtatási kérelmek és egyéb levelezések címe: P. D. Neufer, The John B. Pierce Laboratory, Yale Univ. Orvostudományi Kar, 290 Congress Ave., New Haven, CT 06519 (e-mail: [email protected] org).
- A testedzés súlycsökkenéssel és magas vagy alacsony glikémiás indexű diétával csökkenti az anyagcserét
- A diéta és a testmozgás jelei szabályozzák a SIRT3-at, és aktiválják az AMPK-t és a PGC-1α-t a vázizomzatban
- Fitnesz és egészséged A Testgyakorlás Intézet fizikai, mentális és helyreállító előnyei
- Enhancer Vitaminok és ásványi anyagok anyagcsere webáruház
- Eltérés az önjelölt és a tényleges kalóriabevitel és a testmozgás között elhízott személyeknél - PubMed