A zsírszövet mint immunológiai szerv
Táplálkozástudományi Tanszék, Purdue Egyetem, West Lafayette, Indiana, USA
Összehasonlító orvoslás szekció, Yale School of Medicine, New Haven, Connecticut, USA
Immunobiológiai Tanszék, Yale School of Medicine, New Haven, Connecticut, USA
Táplálkozástudományi Tanszék, Purdue Egyetem, West Lafayette, Indiana, USA
Összehasonlító orvoslás szekció, Yale School of Medicine, New Haven, Connecticut, USA
Immunobiológiai Tanszék, Yale School of Medicine, New Haven, Connecticut, USA
Finanszírozó ügynökségek: A Dixit Lab kutatását részben a Nemzeti Egészségügyi Intézet (AG043608, AG31797, DK090556 és AI105097) támogatja. Ryan Grant-ot a Purdue Egyetem támogatja.
Közzététel: A szerzők nem jelentettek összeférhetetlenséget.
Szerzői hozzászólások: Mindkét szerző hozzájárult a kézirat elkészítéséhez, megírásához és szerkesztéséhez.
Absztrakt
Célkitűzés
Ez az áttekintés a zsírszövet immunológiai aspektusaira és annak potenciális szerepére koncentrál az elhízáshoz társuló társbetegségeket kiváltó krónikus gyulladás kialakulásában.
Mód
Az áttekintés a jelenlegi irodalom PubMed-kereséseit használta a zsírszöveti leukocitózis vizsgálatára.
Eredmények és következtetések
Az elhízott alanyok zsírszövetei gyulladnak és hozzájárulnak az inzulinrezisztencia, a 2-es típusú cukorbetegség és a metabolikus szindróma kialakulásához. Számos immunsejtet, köztük B-sejteket, T-sejteket, makrofágokat és neutrofileket azonosítottak a zsírszövetben, és az elhízás befolyásolja mind az immunsejt-altípusok mennyiségét, mind természetét, amely aktív immunológiai szervként jelenik meg, amely a paracrinon keresztül képes módosítani az egész test anyagcseréjét. és az endokrin mechanizmusok. A zsírszövet egy nagy immunológiailag aktív szerv az elhízás során, és mind a veleszületett, mind az adaptív immunválasz jellemzőit mutatja. Annak ellenére, hogy a hematopoietikus törzs sejtjei vannak a zsírszövetben, nem világos, hogy a zsírrésznek közvetlen szerepe van-e az immunfelügyeletben vagy a gazdaszervezet védelmében. A leukociták és az adipociták közötti kölcsönhatások megértése feltárhatja azokat a klinikailag releváns utakat, amelyek szabályozzák a zsírszövet gyulladását, és valószínűleg olyan mechanizmusokat tár fel, amelyek révén az elhízás hozzájárul az anyagcsere és bizonyos fertőző betegségek iránti fokozott érzékenységhez.
Bevezetés
A túlsúly és az elhízás növekvő gyakorisága hozzájárult a 2-es típusú cukorbetegség és a metabolikus szindróma felgyorsulásához, amelyek nagy hatással vannak a globális egészségre. Epidemiológiai bizonyítékok azt mutatják, hogy az elhízás az Egyesült Államokban a 40 és 85 év közötti emberek halálozásának mintegy 18% -át teszi ki (1). Ezért szükséges az elhízás és társbetegségei, különösen a 2-es típusú cukorbetegség biztonságos és hatékony kezelésének kidolgozása. Egyre növekszik annak felismerése, hogy a krónikus alacsony fokú gyulladás hozzájárul az elhízáshoz társuló társbetegségekhez, és hogy a zsírszövet fő immunológiailag aktív szerv, amely hozzájárul ehhez a gyulladáshoz.
Gyulladás és anyagcserében egészséges és egészségtelen elhízás
Bár úgy tűnik, hogy az anyagcserében egészséges, elhízott egyének védettek az elhízással járó betegségektől, okkal tűnik, hogy az elhízás során a gyulladás és az inzulinrezisztencia kialakulása adaptív mechanizmus lehet a felesleges energia tárolásával járó szervi diszfunkciók kezelésére. Például az elmúlt két évtizedben a pima-indiánoknál és más populációknál végzett vizsgálatok alapján erős bizonyíték áll rendelkezésre arról, hogy a glükóz alacsonyabb aránya: a lipidoxidáció vagy az alacsony légzési hányados a súlygyarapodás csökkent sebességével jár (8-10). Ezekből a korai vizsgálatokból azt feltételezték, hogy az alacsony glükózoxidációs sebesség a glükóz ártalmatlanításának egyidejű csökkenéséhez vezet, és az inzulinrezisztencia biológiai alkalmazkodást jelenthet az alacsonyabb súlygyarapodáshoz a zsírszövetben történő csökkentett energiatároláshoz.
A zsírszövet leukocitózis
A zsírszövet leukocitózisának megértése a zsírszövet makrofágjainak azonosításával kezdődött. Weisberg és mtsai alapvető eredményei. és Xu és mtsai. kimutatták, hogy az elhízás során a makrofágok megnövekedtek a zsírszövetben, és hogy a makrofágok a TNF elsődleges forrása (13, 14). A makrofágok mellett más immunsejteket is azonosítottak, többek között: B-sejtek (15), T-sejtek (16), neutrofilek (17, 18), eozinofilek (19) és hízósejtek (20, 21). A zsírszövet sejtösszetétele plasztikus, és mind az akut, mind a krónikus ingerek szabályozzák, beleértve az étrendet (13, 14, 18), a testsúly állapotát (13, 14), a hideg hatását (22), valamint az etetést és az éhezést (23). A magas zsírtartalmú étrendre adott válaszként a zsírszövet sejtösszetételének változásához vezető események pontos meghatározása még várat magára. Ismert azonban, hogy a neutrofileket 3 napon belül a zsírszövetbe, a makrofágokat 2 hét alatt, a B-sejteket és a T-sejteket pedig 4 héten belül megnövelték a zsírtartalmú étrend után egerekben (15, 18) .
Az egyes sejttípusok összlétszáma fontos, de ezen sejtpopulációk minőségében is változások vannak. Az elhízás és az inzulinrezisztencia képesek elferdíteni az immunsejteket a gyulladáscsökkentő altípusoktól a több gyulladáscsökkentő altípus felé. Ez magában foglalja a makrofág-polarizáció átállítását az M2-szerű sejtekről a proinflammatorikusabb M1-szerű sejtekre (24) és a szabályozó T-sejtek elvesztését a zsírszövetben (25). Az elhízás során bekövetkező ezen összetételi változások helyi hatásai a zsírszövet gyulladását befolyásolják, és befolyásolják az adipociták lipid-raktározási képességét, az adipocita inzulinérzékenységét, a szisztémás glükóz metabolizmust és a metabolikus homeosztázist. A zsírszövet gyulladását kiváltó mögöttes tényezők és sejttípusok nagyon aktív kutatási területek, ugyanakkor az elhízás etiológiájában még mindig sok ismeretlen tényező van - mediált betegség.
Az adipocita stressz és a veszélyhez kapcsolódó molekuláris minták
A túlzott energia hatására az adipociták hipertrófián és/vagy hiperplázián mennek keresztül. Az adipocita mérete korrelál az emberek inzulinérzékenységével, és a kisebb adipocitákkal rendelkezőknél alacsonyabb a gyulladás markere (26, 27); rágcsáló modellek azonban azt mutatják, hogy bizonyos fehérjék hiányában az adipociták nagyméretűek lehetnek, miközben az állat fenntartja az inzulinérzékenységet (28). A zsírszövet szövettani elemzése feltárja a koronaszerű struktúrák jelenlétét, amelyek olyan elhalt adipocitákat körülvevő immunsejtekből állnak, amelyek lipidcseppjeik körül negatívan festik a perilipin negatívumait (29). A korona-szerű struktúrák és az adipocita-halál megjelenése időbeli lefutást követ, amelynek során a magas zsírtartalmú táplálkozás kezdetétől a 16. hétig növekszik az incidencia. A 20. hétre a koronaszerű struktúrák csökkentek a 16. héthez képest, bár a sovány kontroll állatok esetén a szám még mindig megnövekszik, és az egerek inzulinrezisztensek maradnak, bár kisebb mértékben, mint a korona-szerű struktúra előfordulásának csúcsán (29). Ez azt jelzi, hogy a zsírszövet átalakítása adaptív válasz, de nem képes teljes mértékben kompenzálni a tápanyagfelesleget, és végül korlátozza a lipidek tárolását, ami szöveti diszfunkcióhoz vezet.
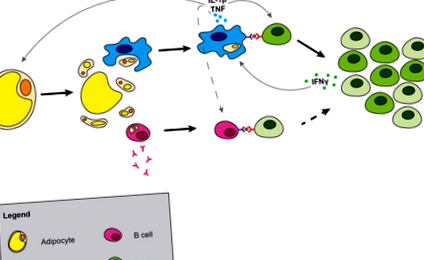
Az adipociták pontos elhalási módja nem világos; azonban a legújabb tanulmányok azt mutatják, hogy az adipocita halála a piroptosis révén haladhat (30). A piroptosis a kaszpáz - 1-től függő sejthalál egy speciális formája, amely magában foglalja a citoszolos alkotórészek szivárgását az extracelluláris térbe. A citoszolos alkotóelemek szivárgása és a lipidcseppek szöveti expozíciója a veszéllyel járó molekuláris minták (DAMP) felszabadulását idézi elő, amelyeket a mintafelismerő receptorok érzékelhetnek (1. ábra). A metabolikus DAMP-k közé tartoznak a szabad zsírsavak (31), a magas glükózkoncentráció (32), ATP (33), keramidok (34) és más szfingolipidek, valamint a koleszterin (35, 36) és az urátkristályok. A közelmúltban kimutatták, hogy az adipociták szintetizálják a húgysavat, és az elhízás során fokozódik a zsírszövet húgysavtermelése (37). Ezek a metabolikus DAMP-k képesek kiváltani a makrofágok aktiválódását és a zsírszövet gyulladását.
Gyulladás kialakulása a zsírszövetben. Az adipocita halála felszabadítja a citoszolos alkotóelemeket, és kiteszi a lipidcseppet. A makrofágok elnyelik vagy aktiválják az adipocita alkotóelemeket, ami a citokinek makrofág termeléséhez vezet. A B-sejtek szintén aktiválódnak, ami antitestek termeléséhez és MHCII-függő T-sejt kölcsönhatáshoz vezet, ami hozzájárulhat az inzulinrezisztenciához. A makrofágok és az antigénbemutatás által szekretált IL - 1β hajtja a T-sejtek klonális terjeszkedését, és a naiv sejtekből az effektor memória sejtekbe tolja el a T sejtek egyensúlyát a zsírszövetben. Szaggatott vonalak jelzik a sejtek közötti lehetséges kölcsönhatást.
A zsírszövet DAMP-k makrofág-érzékelése és antigén bemutatása
A metabolikus DAMP-ket és a kórokozóhoz kapcsolódó molekuláris mintázatokat (PAMP) a veleszületett immunsejtek érzékelik, és gyulladásos utak aktiválódásához vezetnek a mintázatfelismerő receptorok révén, mint például az autópálya-szerű és nukleotid-kötő oligomerizációs domén, amely fehérjeszerű receptorcsaládokat tartalmaz (TLR és NLR) ).) Ezen receptorok, valamint a makrofág markerek eloszlásának elemzése nehézkes volt a zsírszövet enzimatikus diszperziója miatt. A zsírszövet enzimatikus diszperziója elválasztja a zsírszövetet egy felhajtó zsírsejtfrakcióvá és egy stromalis vaszkuláris pelletekké; korlátozott azonban az adipociták és a makrofágok közötti szoros asszociációk és a szabadon lebegő makrofágok jelenléte miatt az adipocita frakcióban (38) .
A TLR család minden tagja (TLR 1–9) a stromalis vaszkuláris és az adipocita frakciókban változó mértékben expresszálódik a zsírszövetben (39). A zsírszövet-gyulladás tekintetében a TLR4 kapta a legnagyobb figyelmet. A TLR4 és a zsírsavak kölcsönhatását összekapcsolják a fetuin A fehérjével (40). A fetuin A-t a TLR4 endogén ligandumának azonosították, és nagy mennyiségben termeli a zsírszövet (40). A kokultúrás rendszerekben a fetuin A-t az adipociták szabad zsírsavaknak való kitettség után szabadítják fel, és képes az M2-szerű fenotípusból az M1-szerű fenotípusba polarizálni a makrofágokat, hasonlóan ahhoz a változáshoz, amely a zsírszövetben az elhízás kialakulása során történik 40). Polarizáló tevékenysége mellett a fetuin A kemoattraktánsként is szolgál a makrofágok számára, ami fokozott forgalmat eredményez a szövet felé (40). A TLR4 ablációja csökkenti a zsírszövet gyulladását, ennek hatása azonban az egész test inzulinérzékenységére nem volt következetes a vizsgálatok során, némelyiknél fokozottabb az inzulinérzékenység (41, 42), míg más nem mutat változást (42) .
T-sejtek részhalmazai, a populációk terjeszkedése és összehúzódása
A B-sejt hozzájárulása a zsírszövet gyulladásához és az inzulinrezisztenciához
A zsírszövetek immunológiai struktúrái
A zsírszövet eloszlása nem egyenletes, és az immunstruktúrák, köztük a korona-szerű struktúrák, a zsírral társult limfoid csoportok (FALC) és a tejszerű foltok, valamint a barnás/bézs zsírsejtek előfordulása alapján regionális. A zsírszöveti régióknak a zsírfunkcióra gyakorolt hatása azonban nem jól ismert. Egyes zsírszövetraktárak, beleértve a rágcsálók inguinalis depóját, valamint számos kis és emberi és emlős emlőraktár nyirokcsomókat tartalmaznak (67 A tengerimalac zsírszövetraktárakkal kapcsolatos kezdeti vizsgálatok azt mutatták, hogy a nyirokcsomók közelében elhelyezkedő zsírszövet-explantánsok a nyirokcsomóktól nem szomszédos zsírszövetekhez képest fokozottan képesek elnyomni a kevert nyirokcsomó-leukocita készítmény mitogén által stimulált proliferációját (67). Érdekes módon a proliferációra gyakorolt hatás megfordult az inzulinkezeléssel. Ezek a megállapítások azt mutatják, hogy a nyirokcsomók közelében lévő zsírszövet szekretált termékei immunszuppresszív képességűek, de ennek mechanizmusa nem ismert. Ezek a vizsgálatok intakt zsírszövet-explantánsokat használtak, így nem világos, hogy az adipociták vagy az immunsejtek szekretált termékeinek voltak-e biológiai hatásai.
Az elhízással járó gyulladás és a kórokozókra adott válasz
Az elhízás számos betegséghez kapcsolódik, többek között: 2-es típusú cukorbetegség, köszvény, ízületi gyulladás, érelmeszesedés, májbetegség és fokozott érzékenység bizonyos kórokozókra. A zsírszövet metabolikus és gyulladásos változásai az elhízással összefüggő patológiát hajtják. A TNF, az IL - 1β és az IL - 6 képes arra, hogy rontja az inzulin működését és a glükóz felvételét a perifériás szövetekben. Noha a szisztémás IL-6 koncentrációk emelkedését általában megfigyelhetjük, a szisztémás IL-1β és a TNF változásai nehezebben észlelhetők, mivel ezek a citokinek alacsony keringő mennyiségben vannak. Helyileg ezek a zsírszövetben lévő citokinek képesek módosítani az adipocita lipolízisét és differenciálódását. Így ezek a citokinek képesek korlátozni a zsírszövetben történő zsírraktározást, és ezt a zsírt elosztják más, méhen kívüli zsírt termelő szövetekben.
Következtetés
Köszönetnyilvánítás
A szerzők köszönetet mondanak Ann Liu-nak az alaktervezésben és az alkotásban nyújtott segítségért.
- Hólyagtörés; Kelp - Növénygyógyszer - Wiley Online Könyvtár
- Kalcitriol és energiacsere - Zemel - 2008 - Táplálkozási vélemények - Wiley Online Könyvtár
- A zsírszövet gyulladása hozzájárul a kísérleti krónikus táplálék által kiváltott testsúlycsökkenéshez
- 100 előadás és 8 óra fitnesz - fogyás terv - online könyvtári oktatás - EllEdu
- A zsírszövet eloszlása előrejelzi a túlélést az amiotróf laterális szklerózisban