Az étrendi linolsav megemeli az endogén 2-AG-t és az anandamidot, és elhízást vált ki
Nemzeti Táplálkozási és Tengeri Halak Kutatási Intézete (NIFES), Bergen, Norvégia
Nemzeti Intézet az alkohol-visszaélésekről és alkoholizmusról, NIH, Bethesda, Maryland, USA
Biomedicina Tanszék, Bergeni Egyetem, Bergen, Norvégia
Nemzeti Táplálkozási és Tengeri Halak Kutatási Intézete (NIFES), Bergen, Norvégia
Nemzeti Intézet az alkohol-visszaélésekről és alkoholizmusról, NIH, Bethesda, Maryland, USA
CardioMetabolic Disease Research, Molekuláris és Sejtbiológiai Tanszék, Nippon Boehringer - Ingelheim, Kobe, Japán
RIKEN Molecular Imaging Sciences Központ, Kobe, Japán
Nemzeti Intézet az alkohol-visszaélésekről és alkoholizmusról, NIH, Bethesda, Maryland, USA
Nemzeti Intézet az alkohol-visszaélésekről és alkoholizmusról, NIH, Bethesda, Maryland, USA
Nemzeti Táplálkozási és Tengeri Halak Kutatási Intézete (NIFES), Bergen, Norvégia
Biológiai Tanszék, Koppenhágai Egyetem, Koppenhága, Dánia
Biológiai Tanszék, Koppenhágai Egyetem, Koppenhága, Dánia
Nemzeti Táplálkozási és Tengeri Halak Kutatási Intézete (NIFES), Bergen, Norvégia
Nemzeti Intézet az alkohol-visszaélésekről és alkoholizmusról, NIH, Bethesda, Maryland, USA
Nemzeti Táplálkozási és Tengeri Halak Kutatási Intézete (NIFES), Bergen, Norvégia
Nemzeti Intézet az alkohol-visszaélésekről és alkoholizmusról, NIH, Bethesda, Maryland, USA
Biomedicina Tanszék, Bergeni Egyetem, Bergen, Norvégia
Nemzeti Táplálkozási és Tengeri Halak Kutatási Intézete (NIFES), Bergen, Norvégia
Nemzeti Intézet az alkohol-visszaélésekről és alkoholizmusról, NIH, Bethesda, Maryland, USA
CardioMetabolic Disease Research, Molekuláris és Sejtbiológiai Tanszék, Nippon Boehringer - Ingelheim, Kobe, Japán
RIKEN Molecular Imaging Sciences Központ, Kobe, Japán
Nemzeti Intézet az alkohol-visszaélésekről és alkoholizmusról, NIH, Bethesda, Maryland, USA
Nemzeti Intézet az alkohol-visszaélésekről és alkoholizmusról, NIH, Bethesda, Maryland, USA
Nemzeti Táplálkozási és Tengeri Halak Kutatási Intézete (NIFES), Bergen, Norvégia
Biológiai Tanszék, Koppenhágai Egyetem, Koppenhága, Dánia
Biológiai Tanszék, Koppenhágai Egyetem, Koppenhága, Dánia
Nemzeti Táplálkozási és Tengeri Halak Kutatási Intézete (NIFES), Bergen, Norvégia
Nemzeti Intézet az alkohol-visszaélésekről és alkoholizmusról, NIH, Bethesda, Maryland, USA
Absztrakt
Bevezetés
Az endokannabinoidok endogén lipidközvetítők, amelyek csak étrendi forrásokból állnak rendelkezésre esszenciális zsírsavakból. A két legjobban jellemzett endokannabinoid, a 2 - AG és az AEA, mindkettő egyetlen zsírsav-prekurzor, az ω - 6 arachidonsav (AA, 20: 4n - 6) metabolikus származékai foszfolipidekben (AA - PL). Mivel az emberek nem tudják szintetizálni az AA-t de novo, a szöveti PL-koncentrációk az ω - 6 és az ω - 3 zsírok étrendi bevitele közötti versenytől függenek (5): (i) linolsav (LA, 18: 2n - 6, az AA prekurzora), (ii) előre elkészített étrendi AA, (iii) α - LA (18: 3n - 3, az eikozapentaénsav (EPA, 20: 5n - 3) és a dokozahexaénsav (DHA, 22: 6n - 3) prekurzora, és (iv) előre elkészített diétás EPA endokannabinoidok. igény szerint enzimatikusan képződött az ω - 6 membrán PL - zsírsav-prekurzorok medencéjéből ((6)). A 20. század folyamán az AA - PL emelkedését az étrendi LA drámai növekedéséből becsülték, amely az a szójababolaj egy főre eső becsült fogyasztásának növekedése az energia 0,006-ról 7,38% -ára ((7)). Itt modelleztük ezeket az ökológiai étrendi változásokat az egerekben annak megállapítására, hogy az LA mint kontrollált étrendi változó növelése emelheti-e az AA - PL összetételt növeli az endokannabinoid szintet, és metabolikus és fenotípusos változásokat indukál, összhangban az elhízással.
Módszerek és eljárások
Etikai megállapítás
A kísérletet az Országos Alkohol- és Alkoholizmus Intézet Állattenyésztési és Felhasználási Bizottsága által jóváhagyott protokoll alapján (Animal Study javaslat: LMBB - JH - 01) követte, és követte az Országos Egészségügyi Intézetek útmutatóját a Laboratóriumok gondozásához Állatok.
Állatok
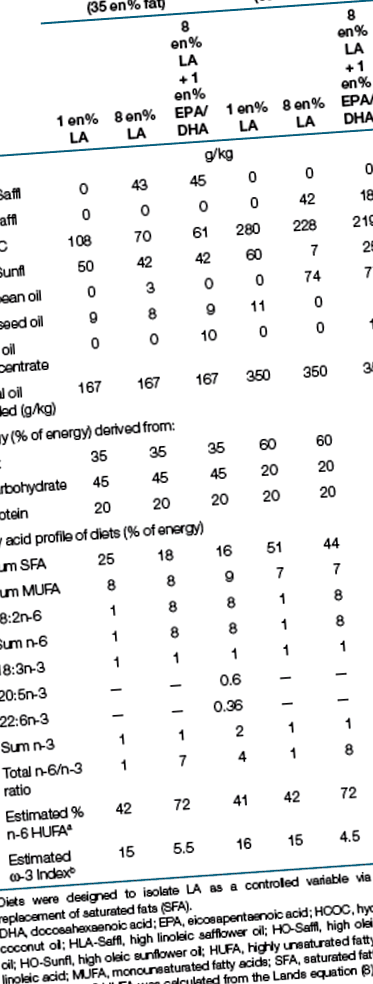
A 2 hétig terhes egereket (e 14) a C57BL/6j; Charles River Laboratories, Stone Ridge, NY) véletlenszerűen osztották be kísérleti étrendbe (Asztal 1). Mindegyik almot (a születéstől számított 48 órán belül hat kölyökre igazítva) ugyanazon étrenden tartottuk anyjukkal. Az állatokat 12:12 órás világos-sötét ciklusban tartottuk fenn. Minden alomból 3–4 hím kölyköt választottak el 23 nap elteltével, és ketrecenként kettőt helyeztünk el (két kölyök ugyanabból az alomból). Mindegyik ketrecben egy állatot fülbe lyukasztottak és az adatok elemzésére használták. Hetente kétszer regisztráltuk mindkét állat egyéni súlyát.
 |
Fogyókúrák
Elérhető volt pelletként (közepesen zsíros étrend) és pasztaként (magas zsírtartalmú étrend) biztosított élelmiszer ad libitum 14 hétig. A diéták (Betlehem, PA) elkészítették az összes étrendet, amely ugyanazt a 20 en% fehérjét (kazeint) és (g/kg) tartalmazta: szacharóz 75, cellulóz 50, ásványi anyag keverék 47, vitamin keverék 13,5, l-cisztein 3 és kolin bitartarát 2,5, etoxikin 0,06. A fehérje- és szénhidrátforrásokat úgy választották meg, hogy minimális legyen a zsírtartalma a háttérben. Az LA-t független változóként hét különféle olaj összekeverésével izoláltuk az egyenértékű α - LA és egyszeresen telítetlen zsírok (Asztal 1). Az étrendi LA változásait csak a telített zsírsavak kölcsönös változásai ellensúlyozták. Például az 1 en% LA tartalmú étrendek 7 en% több telített zsírt tartalmaztak, mint a 8 en% LA diéták. A közepes zsírtartalmú (35 en%) és a magas zsírtartalmú (60 en%) étrend csak a telített zsírok nagyobb mennyiségében különbözik a szénhidrátforrásoktól; dextrin, dyetróz és szacharóz. A táplálékfelvételt minden második nap megmértük az egyes étkezési csészék és a kiömlött anyag mérésével, valamint a korábban összegyűjtött tömeg levonásával.
Endokannabinoid elemzés
Zsírsav-analízis PL-ben
mRNS elemzés és plazma hormonok
Az RNS-t a máj és a fehér zsírszövetekből tisztítottuk (12), és valós idejű reverz transzkripciós PCR-t (13) végeztünk az SREBP - 1c, FAS, ACC1, AMPK a2 és AMPK a2 messenger RNS (mRNS) szintjére. A leptin, az adiponektin és az inzulin plazmaszintjét enzim immunvizsgálattal (ALPCO Diagnostics, Salem, NH) határoztuk meg.
Statisztika
Az összes adatot a STATISTICA 8.0 verziójával elemezzük (StatSoft, Tulsa, OK). Az adatokat a variancia homogenitására elemeztük (Levene-teszt), amely nem jelentéktelen, kivéve a zsírsavak, a 2-AG, az inzulin és az mRNS adatait, amelyeket így Mann-Whitney U-próbával elemeztek. A többszörös tesztelést korrigáltuk a következővel: P
Eredmények
Az étrendi LA megnövekedett szöveti LA-PL, AA-PL, 2-AG + 1-AG és AEA
A 8 en% LA diéta szignifikánsan megemelte az eritrociták LA - PL és AA - PL értékét (2. táblázat), máj3. táblázat, 1a, b ábra) és a hipotalamusz (3. táblázat) összehasonlítva az 1 en% LA diétával. Következésképpen az LA emelkedése majdnem megháromszorozta a máj 2 - AG + 1 - AG és AEA értéket mind közepes, mind magas zsírtartalmú étrendben (1d., F. Ábra). Az EPA majdnem ötször magasabb volt mindkét májban (1c. Ábra) és vörösvértestek (2. táblázat) az 1 en% -ban, összehasonlítva a 8 en% LA diétával. Az LA csökkentése 1 en% -ra emelkedett vörösvértestre (2. táblázat) és a máj DHA (3. táblázat) az előformázott EPA és DHA 1 en% -os hozzáadásához hasonló szintre a legtöbb diéta esetében.
Az étrendi LA szelektív emelése megemeli az AA prekurzorokat és az endokannabinoidokat közepes zsírtartalmú étrendben (nyitott sávok) és magas zsírtartalmú étrendben (durva rúd) táplált egerekben. Az étrendi LA-t 1 en% -ban fehér sávok, 8 en% LA sötétszürke sávok, és 8 en% LA + 1 en% EPA/DHA világos szürke sávok jelzik. Az étrendi LA (8%) emelkedika) máj LA foszfolipidekben (PL) (µg/mg) ésb) máj PL - AA (µg/mg). A 8 en% LA-vel összehasonlítva az 1 en% diétás LA diéták lehetővé teszik a (c) máj PL - EPA (µg/mg), az 1 en% EPA/DHA közvetlen fogyasztásával megegyező szint. Az étrendi LA növelése 1 en% -ról 8 en% -ra megemeli (d) máj 1-AG + 2-AG (ng/mg) (több mint négyszeresére), (e) agy 1-AG + 2-AG (ng/mg), ésf) máj AEA (ng/ml). 1% EPA/DHA hozzáadása csökkenti az endokannabinoid prekurzor készletet és a szöveti 2-AG és AEA koncentrációt. a, b, c, d Különböző betűk jelzik P
Az étrendi LA növelte az élelmiszer-bevitelt, a testsúlyt és az adipozitást
A 8 en% LA diéta növelte a testsúlyt (2e. Ábra és Kiegészítő ábrák S1 és S2 online) és a zsírosság2f. Ábra és 3. ábra) összehasonlítva az LA 1 en% -ával. Az 1 en% LA magas zsírtartalmú étrendben alacsonyabb volt az ételfogyasztás, mint a többi magas zsírtartalmú étrendben, ami az 1 en% LA magas zsírtartalmú étrend kalóriabevitelét eredményezte, hasonlóan a közepes zsírtartalmú étrendhez (2a. Ábra). A 8 en% LA diéta növelte a takarmány-hatékonyságot az 1 en% LA-vel etetett állatokhoz képest (2b. Ábra). A közepes zsírtartalmú étrend takarmányhatékonysága magasabb volt a magas zsírtartalmú étrendhez képest (22,0 ± 0,5 mg/kcal, illetve 18,8 ± 0,5 mg/kcal), P
Az étrendi LA zsírtartalmat vált ki közepes zsírtartalmú étrenddel (nyitott rúd) és magas zsírtartalmú étrendben (durva rúd) táplált egerekben. Az étrendi LA 8 en% -kal nő (a) táplálékfelvétel magas zsírtartalmú étrendben, (b) takarmány-hatékonyság közepesen zsíros étrendben, (c) csökkenti a plazma adiponektint (µg/ml/g zsírszövet) és növelid) plazma leptin (ng/ml). 1 en% LA étrendhez képest 8 en% LA is növekszik (e) testtömeg és (f) adipozitási index. 1 en% EPA/DHA hozzáadása megfordítja a 8 en% étrend hatását. Takarmány-hatékonyság; (testtömeg-gyarapodás/Mcal-bevitel), adipozitási index (szubkután + retroperitoneális + inguinalis zsírpárnák)/kizsigerelt testtömeg × 100). Az adiponektin szintjét a boncolt gramm zsírszövethez igazítottuk (szubkután + inguinalis + retroperitoneális zsírpárnák). a, b, c, d Különböző betűk jelzik P
Az étrendi LA 1% -ra csökkentése megakadályozza a zsírszövet felhalmozódását és megfordítja a magas zsírtartalmú étrend (60 en%) obesogén hatásait. 8 en% LA-vel etetett állatok (b,e) több zsírt halmozott fel, mint az 1 en% LA-vel etetett állatok (a,d). 1 en% n - 3 EPA/DHA hozzáadása 8 en% LA étrendhez (c,f) megakadályozta a zsírszövet növekedését azokban az állatokban, amelyeket 8% LA energiával tápláltak b,e. A magas zsírtartalmú étrend (60 en% zsírtartalom) obesogén tulajdonságai e az LA szelektív 8 en% - ról 1 en% - ra történő csökkentésével és nagyobb telített zsírral történő pótlásával fordítottuk le d. A bemutatott állatok reprezentatívak az egyes diétás kezelések során. Felső sor; izokalórikus közepes zsírtartalmú étrend 35 en% zsírtartalmú, alsó sor; izokaloros, magas zsírtartalmú étrend 60 en% zsírtartalommal. A zsírsavösszetétel, nem pedig az összes zsírkalória határozza meg az étrend obesogén tulajdonságait. DHA, dokozahexaénsav; EPA, eikozapentaénsav; LA, linolsav.
Az étrendi EPA és a DHA csökkentette a szövetek AA-PL, 2-AG + 1-AG, AEA és zsírtartalmát
Arra kerestük a választ, hogy a 2 - AG + 1 - AG és az adipozitási fenotípusok változásai az LA csökkenésének vagy az AA - PL endokannabinoid prekurzornak a PL prekurzor pool arányának (n - 6 erősen telítetlen zsírsavak százalékos arányának) csökkenéséből adódtak - e. (HUFA) vagy% n - 6 forintban). Diétás EPA és DHA (1 en%) hozzáadása a 8 en% LA étrendhez megfordította az AA - PL emelkedését (1b. Ábra), 2-AG + 1-AG (1d. Ábra, e) és a máj AEA (1f. Ábra) hasonló módon, mint az LA 1 en% -ra történő csökkentése. 1 en% EPA/DHA hozzáadása a 8 en% LA étrendhez megakadályozta a szövet% n - 6 növekedését a HUFA-ban (2. táblázat és 3), amelyet a 8 en% LA étrend váltott ki, és csökkentette a takarmány hatékonyságát és az2b., F ábra). Máj és agy 2-AG + 1-AG (1d. Ábra, e), máj AEA (1f. Ábra) és a plazma leptin (2d. Ábra) a tendencia alacsonyabb volt azoknál az állatoknál, akiket 8 en% LA + EPA/DHA diétával tápláltak, összehasonlítva a 8 en% LA diétával. 1 en% EPA/DHA hozzáadása a 8 en% LA étrendhez nagymértékben növelte az ω - 3 indexet az eritrocitákban 4,5-ről 16-ra (P
Az étrendi LA növelte a leptint és csökkentette az adiponektint
A 8 en% LA diétát fogyasztó állatoknál magasabb volt a leptin szint (2d. Ábra) és az alacsonyabb adiponektinszintek (2c. Ábra) plazmában, összehasonlítva az 1 en% LA-vel etetett állatokkal. Hasonló mintát láthattunk 1 en% EPA és DHA hozzáadásával a 8 en% LA étrendhez. Az inzulinszint diétánként nem különbözött (Kiegészítő S1 táblázat online). Az a tény, hogy az inzulinszint nem változott, arra utalhat, hogy ezekben az egerekben az elhízás kialakulása ellenére nem voltak hiperinsulinémiásak, és nem biztos, hogy elérték a metabolikus diszreguláció állapotát, amely a metabolikus szindrómában megfigyelhető szövődményekre jellemző.
Az étrendi LA nem növelte a lipogén génexpressziót
Az mRNS expressziójának különbségeit jobban befolyásolta a teljes zsírmennyiség és a többszörösen telítetlen zsírsavak (PUFA) mennyisége az étrendben, mint az LA és az EPA/DHA tartalom különbségei, és nem követik az étrend által kiváltott zsírosodás és endokannabinoid mintázatát. szintek (S3 kiegészítő ábrák és S4 online). A várakozásoknak megfelelően a magas zsírtartalmú étrendek elnyomták az SREBP-1c, FAS, ACC1, AMPKa1 és AMPKa2 mRNS expresszióját a közepes zsírtartalmú étrendekhez képest (Kiegészítő S3 ábra online). A magas zsírtartalmú étrenden belül az összes PUFA nagyobb mennyisége, mint a 8 en% LA + 1 en% EPA/DHA magas zsírtartalmú étrendben, az SREBP-1c, FAS, ACC1 máj és fehér zsírszövet expressziójának elnyomására irányult., adiponektin, rezisztin és AMPKa1 vagy AMPKa2.
Ökológiai összehasonlítás
Kiválasztottuk a rágcsálók étrendjét 1 en% és 8 en% LA arányban, hogy tükrözzék a zsír táplálékfelvételének növekedését az Egyesült Államokban a 20. század során (7). Feltételeztük, hogy ha az LA hasonlóan endokannabinoid hiperaktivitást vált ki az embereknél, akkor a szójaolaj-fogyasztás összefüggésben áll az elhízás növekvő prevalencia arányával ebben az időszakban (4. ábra). A szójababolaj körülbelül 50 tömegszázalék LA-t tartalmaz, és ez a legnagyobb mértékben hozzájárul az LA növekedéséhez az elmúlt évszázadban. Az élelmiszer-áruk egy főre eső becsült fogyasztását és az esszenciális zsírsavak rendelkezésre állását 273 élelmiszer-áruból a korábban leírtak szerint számoltuk ((7)), az 1909 és 1999 közötti évekre vonatkozó gazdasági eltűnési adatok felhasználásával. Összehasonlítottuk áruk és tápanyagok az Egyesült Államok élelmiszerellátásában az életkorral korrigált elhízás (> 30 BMI) prevalencia arányához a 40–59 éves férfiaknál az Egyesült Államok 1923-as hadseregének veteránjai között (14), a Nemzeti Egészségügyi és Táplálkozási Vizsgálatok (NHANES) között (( (15)) és a Framingham-kohorszok ((16)). Az LA étrendi hozzáférhetőségét nemcsak a szójaolajból számították ki, hanem 273 élelmiszer alapanyagból. Megnövekedett LA fogyasztás (en%)r 2 = 0,68, P 2 = 0,83, P 2 = 0,94, P 2 = 0,86, P 2 = 0,37, P
Étrendi esszenciális zsírok és az endokannabinoidok anyagcseréje. A 2-AG endokannabinoidokat és az anandamidot (AEA) igény szerint szintetizálhatjuk az esszenciális zsírsav-arachidonsavból (AA) (20: 4n-6) membránfoszfolipidekben (AA-PL). Az AA-t a foszfolipid prekurzor medencében étrendi linolsav (LA) (18: 2n - 6) vagy az omega - 3 zsírsavak, nevezetesen az eikozapentaénsav (EPA) és a dokozahexaénsav (DHA) csökkent fogyasztása növelheti. A kannabinoid receptorok (CB1 és CB2) aktiválása AA-PL eredetű endokannabinoidokkal, az AEA-val és a 2-AG-vel, mind központilag, mind periférián, támogatja az étvágygerjesztő, táplálékfogyasztást növelő, a zsírraktározási utakat aktiváló, az adipocita-gyulladást elősegítő és az alacsonyabb szintű metabolikus folyamatokat katabolizmus, amely zsírfelhalmozódást eredményez. Az ábra mutatja a rendelkezésre álló magolaj elmozdulását és az n - 6 erősen telítetlen zsírsavak becsült szövetösszetételének változását, amelyet a Blasbalg ismertet. et al. 2010 ((10)). A vízszintes nyilak azt a hipotézist jelzik, hogy ezek az étrend-változások és az ebből adódó endokannabinoidszintek hozzájárulhatnak az elhízás növekvő előfordulásához az Egyesült Államokban a 20. század folyamán. 2-AG, 2-arachidonoil-glicerin; HUFA, erősen telítetlen zsírsavak; NAT, N-acetil-transzferáz; PLA2, foszfolipáz A2; PLC, foszfolipáz C.
A linolsav (LA) étrendi forrásai és a férfi elhízás növekvő prevalenciája az Egyesült Államokban a 20. század folyamán. A férfi elhízás (40–59 év, BMI> 30) elterjedtségét minden évben a forrás jelzi: UA - Union Army Veterans, F - Framingham kohortok, N - NHANES kohorszok. A szórásgrammokat és az egyváltozós lineáris regressziós vonalakat mindegyik panel jelzi. A férfi elhízás növekvő prevalenciája pozitívan korrelál az LA táplálékforrások látszólagos fogyasztásával (a) baromfi energiaszázaléka (en%), (r 2 = 0,94, P 2 = 0,82, P 2 = 0,86, P 2 = 0,37, P 2 = 0,27, P 2 = 0,49, P
Vita
A 8 en% LA étrenddel összehasonlítva, a 8 en% LA étrend kiegészítése 1 en% EPA/DHA-val alacsonyabb zsírszintet és endokannabinoid szintet eredményezett. A halolaj alapú étrend csökkentette a zsírtartalmat az étrend által kiváltott elhízásban (25) és a kiegészítés 0,8 en% EPA/DHA-val alacsonyabb endokannabinoid szintet és csökkent méhen kívüli zsírlerakódást eredményezett (17). A halolajjal táplált anyák kölykeinek kisebb volt a testsúlya, kevesebb a zsírszövetük és alacsonyabb a 2 - AG értéke a hippocampusban, mint a hidrogénezett növényi olajat tápláló anyák kölykeinek (26). Bár az EPA/DHA kiegészítése 8 en% LA diétával megakadályozta az AA - PL növekedését, az EPA/DHA egy 8 en% LA diétában nem volt ugyanolyan hatékony, mint 1 en% LA sem a túlzott endokannabinoid termelés megelőzésében, sem az anyagcserezavarok helyreállításában. DHA és AA hozzáadása a magas LA-tartalmú nyugati étrendhez (10,7 en%) nem támogatta ugyanazt a frontális kéreg zsírsav-összetételét, mint amelyet alacsony LA-tartalmú étrend (1,2 en%) eredményezett (21). Ezért a szöveti EPA és DHA koncentrációjának javítása és az endokannabinoid túlzott jelátvitelének megakadályozása érdekében az EPA és DHA étrend-kiegészítés mellett a hangsúlyt az étrendi LA csökkentésére kell helyezni.
Elismerés
A tanulmányt az Országos Alkoholfogyasztási és Alkoholizmus Intézet, az NIH, az Országos Táplálkozási és Tengeri Tenger gyümölcseit Kutató Intézet (NIFES), Bergen, Norvégia és a Norvég Kutatási Tanács 186908/l10 támogatta. A halolaj-koncentrátumot a norvég Axellus biztosította. A finanszírozóknak nem volt szerepük a tanulmányok tervezésében, adatgyűjtésben és elemzésben, a kézirat közzétételével kapcsolatos döntésekben vagy elkészítésében.
Közzététel
A szerzők nem jelentettek összeférhetetlenséget.
- Az étrendi linolsav megemeli az endogén 2-AG-t és az anandamidot, és elhízást vált ki
- Az étrendi linolsav emeli az endokannabinoidokat a 2-AG-t és az anandamidot, és elősegíti a súlygyarapodást
- Az étrendi savterhelés és a káliumbevitel összefügg a vérnyomás és a magas vérnyomás prevalenciájával
- A folátos étrend-elégtelenség és a folsav-kiegészítés hasonlóan károsítja az anyagcserét és
- Diétás savterhelés, vérnyomás, éhomi vércukorszint és az inzulinrezisztencia biomarkerei