Biztonságos hőmérsékleti tartomány intraoperatív és korai posztoperatív folyamatos hipertermikus intraperitoneális perfúzióhoz diszkrét disztális gastrectomia modellben, Billroth II rekonstrukcióval
Absztrakt
Háttér
A mostani tanulmány az intraoperatív és a korai posztoperatív folyamatos hipertermikus intraperitoneális perfúzió (IEPCHIP) biztonságosságát kívánta megvizsgálni különböző hőmérsékleteken, diszkrét disztális gasztrektómia modellel Billroth II rekonstrukcióval.
Mód
Harminc sertést véletlenszerűen 5 csoportba osztottak. Két csoportot használtunk kontrollcsoportként (A1 és A2 csoport), 3 csoportot perfúziós csoportként (B, C és D csoport). Az A1 csoportba tartozó sertések disztális gastrectomiát kaptak, csak Billroth II rekonstrukcióval. Az A2, B, C és D csoportba tartozó sertések ugyanazt a műtétet kapták, mint az A1 csoport, majd IEPCHIP következett 37 ± 0,5 ° C, 42,5 ± 0,5 ° C, 43,5 ± 0,5 ° C vagy 44,5 ± 0,5 ° C hőmérsékleten. A perfúziós időt minden A2 sertésnél, valamint a perfúziós csoportnál megvizsgáltuk, és a perfúziókat kétszer végeztük el mindegyik csoportnál. Az első perfúziót intraoperatív módon hajtották végre, a második perfúziót egy nappal a műtét után kezdték meg. Összegyűjtöttük az életjelekre, valamint a máj- és vesefunkcióra vonatkozó adatokat. Összehasonlítottuk az anasztomotikus gyógyulással, az anasztomotikus szövet patológiájával és a hasi tapadással kapcsolatos paramétereket.
Eredmények
Az A1, A2, B és C csoportba tartozó sertések létfontosságú jeleit, máj- és vesefunkcióit ez az eljárás nem befolyásolta szignifikánsan. Ezzel szemben a D csoportba tartozó sertések életjelei, valamint máj- és vesefunkciói jelentősen érintettek. Az A1, A2 vagy B csoportba tartozó sertésekhez képest a C és D csoport sertéseinek anasztomotikus repedési nyomása, törési szilárdsága és hidroxiprolin-tartalma szignifikánsan alacsonyabb volt. Nem figyeltünk meg szignifikáns különbséget ezekben a paraméterekben az A1, A2 és B csoport között. A D-csoportos sertéseknél a hasi tapadás súlyosabb volt. Az A1, A2 és B csoport sertésében a kollagén lerakódása sűrű volt az anastomosisban, gyulladásos sejtek beszűrődését figyelték meg a D csoportban.
Következtetések
Az IEPCHIP 42,5 ± 0,5 ° C-on biztonságos és minimális károsodást okozott. Az anasztomotikus gyógyulást azonban befolyásolta a perfúzió 43,5 ± 0,5 ° C-on és 44,5 ± 0,5 ° C-on, és a hasi tapadás volt a legsúlyosabb a D csoportba tartozó állatoknál, amelyeket 44,5 ± 0,5 ° C-on perfundáltak.
Háttér
Évente világszerte több mint 900 000 új gyomorrákos esetet diagnosztizálnak, és ezeknek az eseteknek a 42% -a Kínában fordul elő [1]. Ezenkívül az előrehaladott gyomorrákok több mint 30% -a együtt jár a peritonealis disszeminációval, és ezeknek a betegeknek a medián túlélési ideje körülbelül 6 hónap [2, 3].
Radikális gyomoreltávolítás után is az előrehaladott gyomorrákban szenvedő betegek több mint 50% -a meghalhat peritoneális kiújulásban [3, 4]. Az elmúlt években a gyomorrák peritonealis carcinomatosisának hipertermikus intraperitoneális perfúziós kemoterápiájával járó javult túlélést [5, 6] mind kísérleti [7], mind klinikai kutatások [5, 8] igazolták. Sőt, a citoreduktív műtét és a hipertermikus intraperitoneális perfúziós kemoterápia a peritonealis carcinomatosisos gyomorrák elsődleges kezelésévé vált [9], és a túlélést intraoperatív és korai posztoperatív intraperitonealis kemoterápiával lehet meghosszabbítani [10, 11]. Ez a kezelés a szabad rákos sejtek operatív tényezőkből vagy spontán disszeminációból eredő időben történő eliminálódását eredményezheti. Így a hipertermikus intraperitoneális perfúzió hatékonynak tekinthető a peritonealis carcinomatosis megelőzésében és/vagy kezelésében, valamint a túlélés elősegítésében [5, 12].
A hipertermikus intraperitoneális perfúziós kemoterápia azonban előrehaladott gyomorrák esetén növeli a perioperatív szövődményeket és a mortalitást [13–18]. A morbiditás és a halálozás aránya 1999 és 2010 között 12% és 66,3%, illetve 0% és 12,5% között mozgott [3].
Úgy gondolják, hogy a korai perfúzió a posztoperatív szövődmények és a mortalitás kockázatának további növekedéséhez vezet. Ennek megfelelően a korai hipertermikus perfúzió biztonsága fontos kérdéssé vált. Az emésztőrendszer rekonstrukcióját követő anasztomotikus helyreállítást a posztoperatív biztonság egyik legfontosabb tényezőjének tekintik. Ha az anasztomotikus malunion szivárgáshoz vezet, hasi fertőzést, tapadó bélelzáródást, anasztomotikus szűkületet és akár szeptikus sokkot is kiválthat [14–16]. Bár az életminőség romlása nem lehet oka ennek a terápiának a megtagadására [19], egyes kutatók úgy vélik, hogy a hipertermia és a kemoterápiás szerek befolyásolják a sebgyógyulást [20]. Ezenkívül a gasztrointesztinális műtétet követő hipertermikus intraperitoneális perfúziós kemoterápia növeli az anasztomotikus szivárgás és a perioperatív mortalitás valószínűségét [17, 21].
Általában a rákos sejteket hatékonyan eliminálják hipertermikus perfúzióval, ha a hőmérséklet meghaladja a 42 ° C-ot [22, 23], bár a 45 ° C-nál nagyobb hipertermia visszafordíthatatlan hepatocita károsodáshoz vezet [24]. Klaver és munkatársai a peritonealis carcinomatosis citoreduktív műtétje után végzett adjuváns kezelést vizsgálták patkány modellben, és hipertermikus intraperitoneális perfúzió 37 vagy 41 ° C-on végzett vizsgálata további tanulmányokat igényel [25].
Ezenkívül kevés vizsgálatot végeztek az intraoperatív és korai posztoperatív folyamatos hipertermikus intraperitoneális perfúzió (IEPCHIP) biztonságos és optimális hőmérsékleti tartományának vizsgálatára a gyomorrák peritonealis carcinomatosisának kezelésében. Így az IEPCHIP vizsgálatát végeztük disztális gastrectomia sertésmodelljében Billroth II rekonstrukcióval, hogy megvizsgáljuk ennek az eljárásnak a biztonságát 37–45 ° C hőmérsékleti tartományban.
Mód
Ezt a tanulmányt a Helsinki Nyilatkozat elveinek megfelelően végezték el, és az érintett intézmények intézményi felülvizsgálati testületei felülvizsgálták és elfogadták annak tervét.
Modellépítés és -menedzsment
Harminc egészséges és érett Bama minipigot használtunk (15 nőstény és 15 férfi). Az állatokat a mini sertés inkubátor biztosította Taizhou városából, Jiangsu tartományból. Ezen állatok átlagos tömege 20 ± 2 kg volt.
A műtét előtt az összes sertést 12 órán keresztül éheztettük. Az eljárást intravénás és inhalációs érzéstelenítésben hajtották végre. Ugyanaz a sebészcsoport elvégezte az összes eljárást a műszaki egységesség biztosítása érdekében.
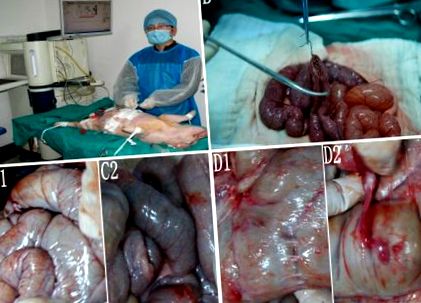
A Bama sertéseket véletlenszerűen 5 csoportba osztották. Az A1 és A2 csoportok szolgáltak kontrollcsoportként, a B, C és D csoportok a hipertermikus perfúziós csoportokat jelentették. Az A1 csoport sertései disztális gyomor-eltávolításon estek át Billroth II rekonstrukcióval (1A. Ábra). A többi csoport megkapta az IEPCHIP-et, miután ugyanazon eljárást hajtotta végre, mint az A1 csoport.
Az eljárás és a posztoperatív tapadás. A, Enteroenterostomia. B, Hipertermikus perfúzió sertésmodellben. C1 és C2, Csoportokban nem figyeltek meg posztoperatív tapadást A 2 és B. D1 és D2, A posztoperatív filmeket és a sűrű tapadást figyeltük meg csoportosan D.
A műtét előtt a has borotválkozással készült. Miután kielégítő érzéstelenítést értünk el steril körülmények között, disztális gyomor-reszekciót végeztünk, és középső metszésen keresztül 3–0 selyemvarrat segítségével (Ethicon, Norderstedt, Németország) gasztrojejunosztómiát és végponttól végig jejunojejunosztómiát készítettünk. Az A2, B, C és D csoportokban két kiáramló katétert helyeztünk a rekeszizom alá, és 2 beáramló katétert helyeztünk mindegyik sertés kismedencei üregébe (1B. Ábra). A katétereket 1–0 selyemvarrattal rögzítettük a környező bőrre (Ethicon, Norderstedt, Németország). Ezután minden bőrmetszést varrtunk a has bezárására.
Az IEPCHIP eljárás
A perfúzió után több hasi szalagot használtunk a hasi bemetszés védelme érdekében. Egyetlen sertés sem kapott táplálékot a műtét után 24 órán át, és az összes állatot intravénásán 80 000 NE gentamicinnel és 0,5 g metronidazollal kezeltük glükóz- és nátrium-klorid-oldatban, 40 ml/kg dózisban. A harmadik napon salakmentes folyékony étrendet alkalmaztak, a hatodik napon pedig az állatok félig folyékony étrendet kaptak, és fokozatosan átálltak a normál étrendre. A sertéseknél posztoperatív intraperitoneális hipertermikus perfúziót is végeztek szisztémás érzéstelenítésben, rögzített lábbal. A fájdalom enyhítésére napi 30 mg tramadolt adtak; ezt a kezelést a műtét után 3 sikeres napon folytatták.
Megfigyelt paraméterek
A sertéseknél 2 órával a beavatkozás előtt, alatt és után 2 órával mértük a légzési gyakoriságot, a vérnyomást, az anális hőmérsékletet és a pulzust. Megfigyeltük a kísérleti állatok posztoperatív állapotát, beleértve a székletürítést, az étrendet, az aktivitást és a súly változását, és osztályoztuk az egyes állatok műtét utáni teljesítményét.
A perifériás vénás vért az összes állatból kivonták a műtét előtt és a műtét után 1 nappal, 3 nappal, 7 nappal és 14 nappal. Kiértékeltük a glutaminos-piruvikus transzamináz (ALT), az albumin (ALB), az összes bilirubin (TBIL), a vér karbamid-nitrogén (BUN) és a kreatinin (CR) szintjét.
Az állatokat a beavatkozás után 14 nappal feláldoztuk, ekkor boncolást hajtottak végre.
Anasztomotikus repedési nyomás, szakítószilárdság és hidroxiprolin tartalom mérése
A hidroxiprolin a kollagén koncentrációjának indexét adja, mivel ez a leggyakoribb aminosav a kollagénben. Kémiai kolorimetriás módszert alkalmaztunk analitikai szempontból tiszta reagensekkel a hidroxiprolin-tartalom kiszámításához a következő képlet alapján: hidroxiprolin-tartalom (μg/mg nedves tömeg) = (spektrofotométer cső abszorbanciája - vak cső abszorbancája/standard cső abszorbancája - üres cső abszorbanciája ) × standard anyagtartalom (5 μg/ml) × hidrolizátum teljes térfogata (10 ml)/a szervezet nedves tömege (mg).
Kóros vizsgálat
Az anasztomotikus szövetet kivágtuk és 4% -os formaldehid-oldatban rögzítettük rutin és szokásos eljárások alkalmazásával. Elkészítettük a paraffin blokkok sorozatos 5 μm-es szakaszait, és hematoxilin-eozinnal (HE) festettük őket. Ezeket a mintákat fénymikroszkóppal értékeltük.
Statisztikai analízis
Az összes kísérleti adatot az SPSS18.0 Statistical Software (SPSS Inc, Chicago, IL, USA) segítségével elemeztük. A máj- és vesefunkcióra vonatkozó adatokat átlag ± SD értékként fejeztük ki. A csoportok közötti különbségeket elemeztük és összehasonlítottuk varianciaanalízissel és Newman-Keuls teszttel. P A 0,05 alatti értékeket statisztikailag szignifikánsnak tekintettük.
Eredmények
A műtét vagy a perfúziós eljárások során nem fordult elő nagyobb komplikáció.
Hasi tapadás és anastomosis
Az A1, A2 (1. ábra, C1) vagy a B (1. ábra, C2) csoportokban tapadás nem volt kimutatható. A C csoportban csak egy membrán tapadással járó esetet figyeltünk meg. A D csoport 3 sertésénél membrán tapadást és sűrű tapadást figyeltünk meg (1D1, D2 ábra).
A gyomor-jejunum anastomosis és a jejunum-jejunum anastomosis átlagos repedési nyomása, szakítószilárdsága és hidroxiprolin-tartalma a C és D csoportban kisebb volt, mint az A1, A2 és B csoportban megfigyelt értékek (2. ábra).
Patológia
Az anastomosis belsejében a kollagénrost képződése látható volt a HE festést követően. A B, C és D csoportokhoz viszonyítva a kollagén sűrűbben deponálódott az A1 és A2 csoportok anastomosisában, jobb granulációval és szövetképződéssel, a nyálkahártya javulása pedig a 2 csoportban jobb volt (3. ábra, A1 és A2). A B csoportban a kollagén lerakódása sűrű volt az anastomosisban (3B. Ábra), és a szabálytalan kollagén lerakódás kisebb mennyiségben volt jelen a C csoportban, mint a B csoportban (3C. Ábra). A kollagén lerakódás a D csoportban volt a legkevésbé sűrű, és gyulladásos sejtek beszűrődése kísérte (3D ábra).
Az anasztomotikus szövet patológiai vizsgálata. A1 és A2, A kollagén sűrűn lerakódott az anastomosisban, a nyálkahártya-csoportok jobb helyreállításával A1 és A2. B, A kollagén sűrűn rakódott le a csoport anasztomózisában B állatok. C, Csökkent és szabálytalan kollagénlerakódást figyeltek meg a csoport anasztomózisában C állatok. D, Csökkent és szabálytalan kollagén lerakódást és gyulladásos sejtek beszivárgását figyelték meg az anastomosis csoportban D állatok.
Perioperatív életjelek
A perfúzió előtt kapott értékekhez képest az A1 és A2 csoportba tartozó sertések testhőmérséklete stabil volt, csakúgy, mint a pulzus, a légzésszám és az átlagos artériás nyomás az eljárás során. Ezenkívül a B és C csoportba tartozó állatok perfúziója után a testhőmérséklet átlagosan körülbelül 1 ° C-kal emelkedett, a pulzus átlagosan 105 ütem/percre, a légzésszám percenként 35-szeresére nőtt, és az átlagos artériás nyomás körülbelül 25 Hgmm-rel csökkent. Két órával a beavatkozás után ezekben az állatokban a vitális jelek elérték a normális szintet. A D csoportban az átlagos hőmérséklet 1,5 ° C-kal emelkedett, a pulzus kb. 120 ütem/percre emelkedett, a légzésszám percenként 40-szeresére emelkedett, és az átlagos artériás nyomás körülbelül 35 Hgmm-rel csökkent. Ezen állatok létfontosságú jelei az eljárás után 2 órán belül nem normalizálódtak.
Műtét utáni gyógyulás
Minden sertés hajlamos volt az első nap nagy részében. Az A1, A2, B és C csoportba tartozó sertések az eljárás után 1 nappal állni és sétálni tudtak. 2 nap elteltével az állatok inni és enni tudtak. Az eljárás után a C csoportban csak 1 sertés hányt kétszer az első napon. Ezenkívül az állatok mentális és teljesítőképességi állapota igazságos volt. A D csoportba tartozó állatok azonban az eljárás utáni napon nem tudtak állni, és három sertés folyamatosan felnyögött. Két nappal később az állatok csak inni tudtak, de a harmadik napon ezek a disznók enni kezdtek. A D csoportban egy sertés az első napon kétszer hányt; és egy másik disznó naponta 6-szor hányt 3 egymást követő napon.
Máj- és vesefunkció
Az ALT, TBIL és ALB szintje az A1 és A2 csoport sertésében stabil maradt. 37 ± 0,5 ° C, 42,5 ± 0,5 ° C és 43,5 ± 0,5 ° C perfúziós hőmérsékleteken a 60 perces folyamatos hipertermikus intraperitoneális perfúzió nem volt szignifikáns hatással a máj vagy a vese működésére. 1 hét elteltével az A1 és A2 csoportba tartozó sertések normál szintre kerültek. Ezzel szemben 44,5 ± 0,5 ° C hőmérsékleten egy 60 perces folyamatos hipertermikus intraperitoneális perfúzió komolyan károsította az állatok máj- és veseműködését. Ez a vese- és májfunkció-károsodás legalább 2 hétig tartott. A máj- és vesefunkcióval kapcsolatos paramétereket az 1., 2. és 3. táblázat mutatja a B, C és D csoportba tartozó sertések esetében.
Vita
Korábbi vizsgálatokban intraoperatív hipertermikus intraperitoneális kemoterápiát (IHIC) és korai posztoperatív intraperitoneális kemoterápiát kombinálva végeztek [10, 26–28]. Javult túlélésről számoltak be ezekben a vizsgálatokban, bár bizonyos mértékű halálozással és súlyos szövődményekkel [11, 29]. Az IEPCHIP célja a szabad rákos sejtek elpusztítása és a mikroléziók eltávolítása a citoreduktív műtét után.
A perfúziós folyamat során a vizsgált állatok létfontosságú jelei a perfúziós csoportokban változtak. Az A1, A2, B és C csoportba tartozó sertések gyorsan felépültek, és a műtét után hamarabb ettek és ittak, mint a D csoportba tartozó sertések. Mint fentebb bemutattuk, a 44,5 ± 0,5 ° C-os perfuzátum jelentős és tartós hatást gyakorolt az állatok életfontosságára jelek és étrend.
A májat érzéstelenítés és hipertermikus intraperitoneális kemoterápia is befolyásolhatja. Egy korábbi vizsgálatban a hipertermikus intraperitoneális kemoterápiás csoportban, 41 ° C-on kezelt egerek máj- és vesefunkciói nem különböztek szignifikánsan attól a normál hőmérsékleti csoporttól, amely paclitaxel és béta-ciklodextrin készítményt kapott [30]. Ezekben a tanulmányokban a hőstresszről úgy gondolták, hogy májkárosodást okoz, ami az idő múlásával súlyosbodott, és azt gondolták, hogy komplex oxidatív stressz válaszok sorozatából származik [31]. Jelen kísérletben a máj és a vesefunkció változásai az A2, B és C csoportokban reverzibilisek voltak. A perfúzió 37 ± 0,5 ° C-on, 42,5 ± 0,5 és 43,5 ± 0,5 ° C-on szintén a kapcsolódó fiziológiai paraméterek átmeneti és enyhe emelkedését okozta. Mindazonáltal a 44,5 ± 0,5 ° C-os perfúzióval ezek a paraméterek lényegesen megváltoztak, ami nyilvánvaló máj- és veseműködést eredményezett. A 44,5 ± 0,5 ° C-on végzett két perfúzió tartós és nyilvánvaló máj- és vesefunkció-károsodást váltott ki.
Mivel a túlélési arány javult a citoreduktív műtét és a gyomorrák IEPCHIP után, a további kemoterápia toxicitását szorosan figyelemmel kell kísérni. A reszekálható gyomorrák hipertermikus intraperitoneális kemoterápiájával végzett randomizált, kontrollált vizsgálatok metaanalízisében 6 vizsgálat posztoperatív mortalitási aránya 2,6% volt (10/385) [11]. 1290 betegből álló, több intézményt lefedő vizsgálatban, amely a nem petefészek eredetű peritonealis carcinomatosis kezelését citoreduktív műtéttel és perioperatív intraperitonealis kemoterápiával vizsgálta, a halálozási arány 4,1% volt [28]. Egy másik, a kolorektális rákból származó peritonealis carcinomatosis esetében végzett cytoreduktív műtétet intraoperatív és posztoperatív intraperitoneális kemoterápiával kombinált többintézményi vizsgálatban a kapcsolódó halálozási arány 4% volt (20/506) [29].
A további kemoterápia túlzottan kockázatos lehet ezeknek a betegeknek, és a rákos őssejtek számának esetleges növekedése kemoterápia után további aggodalomra ad okot [38]. A hipertermikus perfúzió is hatékony lehet, amely jobb életminőséget tesz lehetővé az előrehaladott gyomorrák kezelései után észlelt szövődmények némelyike nélkül. Ezenkívül a hipertermikus intraperitoneális kemoterápiával végzett cytoreduktív műtét az idős betegeknél jelentős morbiditás és mortalitás mellett meghosszabbítja a túlélést [39]. A hipertermikus intraperitoneális perfúzió kemoterápia nélkül különösen alkalmas idős, rossz teljesítményű betegek vagy azok számára, akik nem tolerálják a kemoterápiát. Ezért kemoterápia nélkül intraoperatív és korai posztoperatív folyamatos hipertermikus intraperitoneális perfúziót végeztünk 34 előrehaladott gyomorrákban szenvedő betegnél 2011 óta.
A fent említett okok miatt a jelenlegi tanulmány az elfogadható hőmérsékleti tartomány meghatározására összpontosított, amely a kemoterápiával vagy anélkül végzett hipertermikus intraperitoneális perfúzió alapja.
Következtetések
Megállapítottuk, hogy az IEPCHIP 42,5 ± 0,5 ° C-on nem károsította szignifikánsan a befogadó sertéseket az életjeleik, a májműködés, a vesefunkció és az anasztomotikus gyógyulás szempontjából. Ezenkívül nem jelentett anasztomotikus szivárgás és hasi tapadás kockázatát. Így a perfúzió 42,5 ± 0,5 ° C-on biztonságos és megfelelő volt az IEPCHIP számára, míg a perfúzió 43,5 ± 0,5 ° C-on vagy 44,5 ± 0,5 ° C-on káros volt, és kimutatták, hogy jelentősen rontja az anasztomotikus gyógyulást.
- Az űrben termesztett saláta biztonságos enni, állítja a tanulmány; finom, mondják az űrhajósok
- Oroszország Hőmérsékletrekord a sarki kör mögött
- Elhízás és célorientált intraoperatív folyadékterápia - teljes szöveges nézet
- Természetes aromák A biztonságos használat végső útmutatója - tökéletes keto
- Biztonságos testépítés Több izom kevesebb étrend fehérjével