Epesavval indukált mallory testformálás a gyógyszer alapú egérmájban
Peter Fickert
Orvostudományi * és Kórtani Tanszékről, † Karl-Franzens Egyetem, Graz, Ausztria
Michael Trauner
Orvostudományi * és Kórtani Tanszékről, † Karl-Franzens Egyetem, Graz, Ausztria
Fuchsbichler Andrea
Orvostudományi * és Kórtani Tanszékről, † Karl-Franzens Egyetem, Graz, Ausztria
Conny Stumptner
Orvostudományi * és Kórtani Tanszékről, † Karl-Franzens Egyetem, Graz, Ausztria
Kurt Zatloukal
Orvostudományi * és Kórtani Tanszékről, † Karl-Franzens Egyetem, Graz, Ausztria
Helmut Denk
Orvostudományi * és Kórtani Tanszékről, † Karl-Franzens Egyetem, Graz, Ausztria
Absztrakt
Nemrégiben kimutattuk, hogy az obstruktív kolesztázis vagy a kolinsav (CA) táplálása CK-túlzott expresszióhoz vezet, amely rendellenes foszforilációval jár együtt az egér májában; Mindazonáltal az ok-okozati összefüggés a potenciálisan toxikus epesavak visszatartásával és az MB képződés között továbbra sem tisztázott. Ezt a tanulmányt annak tisztázására tervezték, hogy a kolesztázis és az epesavak önmagukban okozó tényezőket jelentenek-e az MB képződésében. Ezért egy jól definiált kísérleti egérmodellben (azaz a gyógyszerben) megvizsgáltuk az obstruktív kolesztázis hatását közös epevezeték-ligációval (CBDL) és CA-táplálással (a fő primer epesav megtartásának utánzására) az IF citoszkeleton és MB képződésére. alapozott egérmáj). 2,4,18-21 Bizonyíték van arra, hogy a kolesztázis és az epesavak központi szerepet játszanak az MB kialakulásában.
Anyagok és metódusok
Állatok
Hím svájci albínó egereket (Him OF1 SPF törzs) a Bécsi Egyetem Orvostudományi Egyetem Laboratóriumi Állatkutatási Intézetéből (Himberg, Ausztria) szereztünk be, 12:12 órás világos-sötét ciklusban elhelyezve, és ad libitum víz és szokásos egér diéta (Marek, Bécs, Ausztria). A kísérleteket 2 hónapos, 25-30 g tömegű egerekkel végeztük. A kísérleteket a helyi etikai bizottság jóváhagyta, és azok az Egyesült Államok Nemzeti Tudományos Akadémia által készített, a Nemzeti Egészségügyi Intézetek által kiadott, a laboratóriumi állatok gondozására és felhasználására vonatkozó útmutatóban (NIH 86–23. módosítva 1985). A CA-t és a DDC-t Aldrich-től (Steinheim, Németország) szereztük be.
DDC mámor
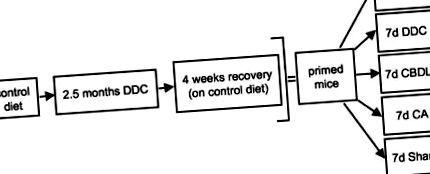
Az egereket 0,1% DDC-t tartalmazó étrenddel etették 2,5 hónapon keresztül, hogy MB-ket indukáljanak. 2,4 Ezen időtartam elteltével az állatok egy csoportját feláldoztuk a DDC által kiváltott citoszkeletális változások, köztük az MB képződésének felmérésére, míg egy másik csoportot 4 héttel feláldoztunk a DDC etetés abbahagyása után, hogy tanulmányozzuk e változások reverzibilitását az előzőekben leírtak szerint. 4 Ezenkívül a kinyert primer egereknek 7 napig 0,1% DDC-t tartalmazó étrendet támasztottak alá, vagy CBDL vagy CA etetésnek vetették alá őket (lásd 1. ábra ▶ a kísérleti tervet).
Kísérleti tervezés a kolesztázis és az epesavak MB-képződésben betöltött szerepének tanulmányozására gyógyszeralapú egerekben. Az egereket 2,5 hónapig kontroll étrendben vagy 0,1% DDC-vel kiegészített étrendben táplálták MB-k kiváltására. Az állatok egyik csoportját feláldoztuk a DDC által kiváltott citoszkeletális elváltozások (beleértve az MB képződést is) tanulmányozására, míg egy másik csoportot 4 héttel feláldoztunk a DDC etetés (helyreállítás) leállítása után, hogy értékeljük e változások reverzibilitását. Ezenkívül a visszanyert (alapozott) egerek kontroll étrendet (Co) kaptak, vagy 7 napig DDC újratáplálást (DDC), CBDL, CA etetést és színlelt műveletet végeztek velük. Minden csoportban öt állatot vizsgáltak.
Az összes műtéti eljárást steril körülmények között hajtották végre. Az obstruktív kolesztázis CK-expresszióra és MB-képződésre gyakorolt hatásának tanulmányozásához gyógyszerrel kezelt egerekben a közös epevezetéket a máj hilumhoz közel ligálták, közvetlenül a bifurkáció alatt, és a ligatúrák között boncoltuk, ahogyan azt korábban leírtuk. Ezen kívül kolecisztektómiát végeztek a cisztás csatorna lekötése után. A kontrollokat színlelt műveletnek vetették alá expozícióval, de a közös epevezeték lekötése és az epehólyag eltávolítása nélkül. A májat általános érzéstelenítésben (10 mg Avertin i.p.) kivágtuk 7 nappal a műtét után. A májszövet mintákat folyékony nitrogénben fagyasztották molekuláris elemzés és immunfluoreszcens mikroszkópia céljából, vagy 4% semleges pufferolt formaldehid oldatban rögzítették a fénymikroszkópos és immunhisztokémiai célokra. Az egerek szérummintáit -70 ° C-on tároltuk az aszpartát-aminotranszferáz/alanin-aminotranszferáz, az alkalikus foszfatáz és az összes epesavszint elemzéséhez.
Epesavak etetése
Az epesavak CK-expresszióra és MB-képződésre gyakorolt hatásainak tanulmányozásához a gyógyszerrel kezelt egereket 7 napig CA-val (1%) kiegészített étrendben táplálták. 22.24 A májat és a szérumot a fent leírtak szerint dolgoztuk fel.
Az mRNS másolatszámának meghatározása
A CK 8, CK 18 és glicerinaldehid-3-foszfát-dehidrogenáz mRNS kópiaszámát kompetitív reverz transzkriptáz-polimeráz láncreakcióval határoztuk meg. 10.
A CK 8 és a CK 18 Western-blot-vizsgálata
A CK 8 és CK 18 fehérjeszinteket Western blot analízissel határoztuk meg. 4.22
Immunfluoreszcens mikroszkópia
Az immunfluoreszcens mikroszkópiát fagyasztott májszelvényeken (3 μm vastag, acetonban fixáltuk -20 ° C-on 10 percig) végeztük az MM120-1 monoklonális antitest felhasználásával, amely specifikusan felismerte az MB-ket és a CK 8 és CK 18 elleni nyúl CK antitest 50K160 korábban leírták. 4,22,25 Ezenkívül a CK8 foszforilezését az 5B3 antitesttel értékeltük a CK 8 hiperfoszforilezett epitópja ellen. 4,26 Kettős immunjelölést végeztünk, kombinálva az MM120-1 vagy 5B3 monoklonális antitesteket az 50K160 poliklonális antitesttel. Szekunder antitestként Cy2-konjugált kecske anti-egér IgG-t (Amsersham, Buckinghamshire, Egyesült Királyság) és tetrametil-rodamin-izotiocianát-konjugált sertés nyúl-ellenes Ig-t (DAKO, Glostrup, Dánia) használtunk. A kontrollhoz az elsődleges antitesteket megengedték vagy helyettesítették izotípus-illesztett immunglobulinokkal (DAKO). Az immunfluoreszcens mintákat egy Zeiss Axiophot mikroszkóphoz rögzített MRC 600 (Bio-Rad, Richmond, CA) lézerszkennelő konfokális eszközzel elemeztük. A fluoreszcens képeket a konfokális fényszorzó cső segítségével gyűjtöttük teljes képkockával, 768 × 512 képpont.
Szövettan
Az egérmájokat 4% semleges pufferolt formaldehid-oldatban rögzítettük és paraffinba ágyazottuk. A 4 μm vastag metszeteket hematoxilinnal és eozinnal festettük.
Immunhisztokémia
Az immunhisztokémiát egy ubiquitin elleni antitest alkalmazásával hajtottuk végre (hígítás 1: 200; DAKO). A formaldehid-fixált szövet parafin szakaszait (4 μm vastagságú) deparaffinizáltuk, rehidráltuk és 0,1% -os proteázzal emésztettük (XXIV típus; Sigma, St. Louis, MO). Az ubiquitin antitest megkötését az ABC rendszer (DAKO) segítségével detektáltuk, a korábban leírtak szerint. 8.
Rutin szérum biokémia és epesav mérések
A szérum alanin-aminotranszferáz, az aszpartát-aminotranszferáz és az alkalikus foszfatáz szintjét rutinvizsgálattal határoztuk meg Hitachi 717 analizátorral (Boehringer Mannheim, Mannheim, Németország), a különböző kezelési módok májtoxicitásának és a kolesztázis mértékének mérésére. Az összes szérum epesavszintjét egy kereskedelemben kapható 3a-hidroxi-szteroid-dehidrogenáz-vizsgálattal (Merck, Darmstadt, Németország) határoztuk meg. A vizsgálatokat két példányban hajtották végre.
Statisztikai analízis
Az értékek átlag ± SEM. AST, aszpartát-aminotranszferáz (U/L); ALT, alanin-aminotranszferáz (U/L); AP, alkalikus foszfatáz (U/L); BA, epesavak (μmol/L).
* P ▶ ▶ ▶. Érdekes módon az epeinfarktusok mértéke sokkal kevésbé volt hangsúlyos a gyógyszerrel kezelt CBDL egerekben, mint a naiv CBDL egerekben (amelyek túlnyomórészt az 1. és 2. acináris zónában találhatók; nem látható). 22.27 A CBDL a CK 8 és a CK 18 mRNS szintjének szignifikáns növekedését eredményezte a gyógyszerrel alapozott visszanyert egerekhez és a naiv kontroll étrenddel etetett egerekhez képest (2A. Ábra) ▶ a CK fehérje expressziójának növekedésével járt együtt (2B ábra) ▶. A DDC újratöltéséhez hasonlóan a CK 8 relatív növekedése meghaladta a CK 18ét a CBDL gyógyszerrel kezelt egerekben (2B. Ábra) (. Az álműveletnek nincs hatása a CK 8 és CK 18 mRNS és fehérje expressziójára, valamint az MB képződésére (nem látható).
A CA etetés CK túlzott expressziót és MB képződést vált ki a gyógyszer alapú egérmájban
A kolesztázis mechanikai (pl. Megnövekedett csatornás nyomás) és toxikus hatások (pl. Epesav által kiváltott toxicitás a megnövekedett epesavkoncentrációk) további megkülönböztetése az MB képződés szempontjából a gyógyszerrel kezelt egereket potenciálisan toxikus táplálékkal táplálták A CA, amely az emberi kolesztatikus májbetegség egyik fő epesavját képviseli. 22,24,28,29 A naiv, CA-vel táplált egereken végzett korábbi vizsgálatainkkal összhangban a 22,24 CA-táplálás szignifikánsan növelte a szérum transzaminázok, az alkalikus foszfatáz és a szérum epesavak szintjét a gyógyszerrel kezelt egerekben (1. táblázat) ▶ . A gyógyszerrel kezelt egerek CA táplálása a hepatocyták megnagyobbodásával, a disszeminált hepatocelluláris nekrózissal, mitózisokkal, az interlobuláris epeutak dilatációjával és a periductalis ödémával volt összefüggésben (nem látható). Ezenkívül ez a kezelés szignifikánsan megemelte a CK 8 és a CK 18 mRNS és fehérje szintet, összehasonlítva a gyógyszerrel alapozott visszanyert egerekkel és a naiv kontroll étrenddel táplált egerekkel (2. ábra, A és B ábra). A CK 8 fehérje szintjének növekedése meghaladta a CK 18 szintjét; a különbség azonban kevésbé volt kifejezett, mint a DDC-re reflexelt és a CBDL gyógyszerrel kezelt egereknél (2B. ábra) (. A CA-táplálás hasonló mértékben indukálta a MB képződését, mint a gyógyszerrel kezelt CBDL egereknél (2F, 3D és 4D ábra) (▶ ▶ .
A CBDL és a CA táplálása a kábítószer-alapú egérmájban a CK-k rendellenes foszforilációját és ubiquitinációját váltja ki
Vita
Az MB-k a hepatocelluláris citoplazmatikus zárványok és a krónikus májbetegségek morfológiai jellemzői, beleértve az alkoholos és alkoholmentes steatohepatitist, valamint a krónikus kolesztázisokat. 2,3 Tanulmányi tárgyként is szolgálhatnak, hogy betekintést nyerhessenek az inklúziós testekkel járó sejtsérülés (azaz a különféle fehérje-aggregációs betegségek) általános elveibe. 2,3,30,34,35 A vizsgálat célja annak meghatározása volt, hogy a kolesztázis és a potenciálisan toxikus epesavak miként váltják ki az MB képződését a gyógyszerrel kezelt egérmájban. Kimutatták, hogy mind az obstruktív kolesztázis, mind a CA táplálás néhány napon belül a CK-k túlexpressziójához, rendellenes foszforilációjához és ubiquitinációjához, végül MB-képződéshez vezet a gyógyszerrel alapozott egérmájban. Ezek az eredmények bizonyítékot szolgáltatnak a potenciálisan toxikus epesavak kulcsfontosságú szerepére az MB képződésében kolesztatikus májbetegségekben.
A CK-IF-ket régóta meglehetősen statikus szerkezeteknek tekintik, amelyek elsősorban felelősek a sejtek mechanikai stabilitásáért. 1 Egyre nyilvánvalóbb azonban, hogy a CK-IF fehérjék további sejtfunkciókban vesznek részt (pl. Védekezés a toxikus stressz ellen és az apoptotikus utak modulációja). 10,26,36-40 A CK-k fontosságát a hepatocyták funkcionális integritásának fenntartásában számos gén knockout egérmodell bizonyította. 2,10,40 Ezenkívül a CK mutációk, valamint a CK-k poszttranszlációs módosításai szintén szerepet játszhatnak az emberi májbetegségek patogenezisében, mivel a kriptogén cirrhosisban szenvedő és a humán alkoholos steatohepatitisben megfigyelt kifejezett kóros CK foszforilációban szenvedő betegeknél a CK 8 gén mutációi nemrégiben bebizonyították. 8,41,42 Ezen megállapítások alapján feltételezhető, hogy a fokozott máj CK-expresszió rendellenes foszforilációval, ubikvitinációval és az ebből eredő MB-képződés a májsejt eddig ismeretlen védekező reakcióját jelenti a toxikus sérülésekre (pl. Mérgező epesav által kiváltott oxidatív feszültség).
A jelenlegi vizsgálat eredményei arra utalnak, hogy a potenciálisan mérgező epesavak MB-képződéshez vezetnek, kiegyensúlyozatlan túlexpressziót, rendellenes foszforilációt és poliubikvitinációt, valamint a CK-k csökkent degradációját indukálva a gyógyszerrel alapozott egérmájban. Érdekes lesz megnézni, hogy ezek az állatmodellekben kapott eredmények relevánsak-e az emberi kolesztatikus májbetegségek szempontjából is. Az oxidatív stressz lehet a végső közös elv a fehérje-aggregációs rendellenességek különböző típusaiban, beleértve a kolesztatikus májbetegségeket is. 49-51
Köszönetnyilvánítás
Köszönjük Dr. Bishr M. Omary (Orvostudományi Tanszék, Palo Alto VA Orvosi Központ és Stanford Egyetem, Stanford, Kalifornia) hiperfoszforilezett CK epitópok elleni antitestek biztosításáért, Drs. W. Erwa (Graz) és munkatársai a májfunkciós tesztek elvégzéséért, valamint Dr. R. Aigner (Graz) és munkatársai a szérum epesavszintjének mérésére.
Lábjegyzetek
Cím újranyomtatási kérelmek Helmut Denk, M.D., FRCPath, Patológiai Tanszék, Karl-Franzens Egyetem, Auenbruggerplatz 25, A-8036 Graz, Ausztria. E-mail: .ta.ca.zarginufk @ kned.tumleh
Támogatja az Osztrák Tudományos Alapítvány (S 7401-MOB támogatás a KZ-nek és P-15502 az MT-nek), az Osztrák Nemzeti Bank Jubileumi Alapja (7171 és 8522 támogatás az MT-nek), valamint az osztrák Társaság Joseph Skoda-díja Belgyógyászat (MT-ig).
- 10 étel, amely méregteleníti a tested és megtisztítja a májadat
- Anne Hathaway; s A majdnem vegán étrend lehetővé tette macskanőjének testét
- A hasi zsír elősegíti a cukorbetegséget a máj megrendelése alapján
- 5 egészséges szokás, amely kimeríti a szervezeted ásványi anyagait
- 10 legjobb száraz kutyaeledel májbetegségek számára 2020-ban