Potenciális kapcsolat a foszfát és az öregedés között - Klotho-hiányos egerek tanulságai
Makoto Kuro-o
Patológiai Osztály, a texasi egyetem délnyugati orvosi központja, Dallas, 5323 Harry Hines Blvd., Dallas, Texas 75390-9072, telefon: (214) 648-4018, fax: (214) 648-4070
Absztrakt
A foszfát homeosztázist elsősorban a csont-vese endokrin tengely tartja fenn. Ha a foszfátfelesleg van, a fibroblaszt-23 növekedési faktor (FGF23) kiválasztódik a csontból, és a vesére hat, hogy elősegítse a foszfát vizelettel történő kiválasztását. Az FGF23 csökkenti a szérum D-vitamin szintjét is, hogy elnyomja a bélből a foszfát felszívódását. Így az FGF23 hormonként működik, amely negatív foszfátegyensúlyt indukál. Az FGF23 egyik kritikus jellemzője, hogy a Klotho-t, a vesetubulusokban expresszált egyszeres transzmembrán fehérjét igényli kötelező társreceptorként a rokon FGF receptorok megkötésére és aktiválására. Fontos, hogy az FGF23 vagy a Klotho hibái nemcsak a foszfátretenciót, hanem az egerek korai öregedési szindrómáját is előidézhetik, amelyet a hiperfoszfatémia feloldásával lehet megmenteni. Ezenkívül az extracelluláris és intracelluláris foszfátkoncentráció változásai befolyásolják a glükóz metabolizmusát, az inzulinérzékenységet, valamint az oxidatív stresszt in vivo és in vitro, amelyek potenciálisan befolyásolhatják az öregedési folyamatokat. Ezek az eredmények váratlan összefüggésre utalnak a szervetlen foszfát és az emlősök öregedése között.
1. Bemutatkozás
2. A foszfát-anyagcsere endokrin szabályozása
3. Az FGF23 hatás molekuláris alapjai
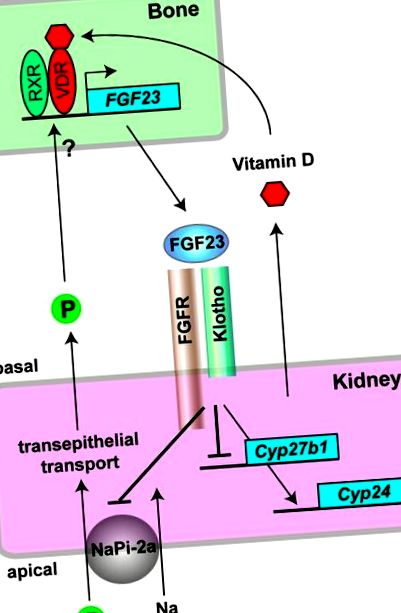
A legfrissebb vizsgálatok azonosították a Klotho-t, a vesében expresszált egyszeres transzmembránfehérjét, mint ko-faktort, amely szükséges ahhoz, hogy az FGF23 megkötődjön az FGFR-ekhez (Kurosu et al., 2006; Urakawa et al., 2006). A klotho fehérje konstitutív bináris komplexet alkot több FGFR-rel (FGFR1c, 3c és 4), és növeli azok specifikus affinitását az FGF23 iránt. Más szóval, a Klotho az FGF23 kötelező társreceptoraként működik. Valójában a Klotho-hiányos egerek teljesen ellenállnak az FGF23-nak és foszfát-visszatartó fenotípusokat mutatnak, mint az FGF23-deficeint egerek (Tsujikawa et al., 2003; Yoshida et al., 2002). A Klotho vese-specifikus kifejezése megmagyarázza, hogy az FGF23 miért ismeri fel a vesét célszervként sok FGFR-t expresszáló szerv között. A klotho fehérje azért fejlődhetett ki, hogy kompenzálja az FGF23 heparán-szulfáttal szembeni alacsony affinitását, és specifikusan támogatja az FGFR aktiválását az FGF23-mal, amely új mechanizmust jelent a célszervek redundáns ligandum-receptor kölcsönhatásokban való korlátozására. Így Klotho és FGF23 a csont-vese endokrin tengely fontos alkotóelemeként jelent meg, amely szabályozza a foszfátanyagcserét (Kuro-o, 2006, 2008; Kurosu és Kuro-o, 2008, 2009b; Liu és mtsai, 2007; Liu és Quarles, 2007).
A csont-vese endokrin tengelyeket az FGF23 és Klotho közvetíti. Az oszteocitákban a D-vitamin aktív formája (1,25-dihidroxi-D3-vitamin) kötődik a D-vitamin receptorhoz (VDR), és egy másik nukleáris receptorral (RXR) heterodimereket képez az FGF23 gén transzkripciójának transzaktiválása céljából. A foszfát (P) szintén növeli az FGF23 expresszióját a csontban, de annak mechanizmusát még meg kell határozni. A csontból kiválasztott FGF23 a Klotho-FGFR komplexre hat, a vesében a vese hámjában expresszálódik. Foszfatirikus hormonként az FGF23 gátolja a transzepitheliális foszfát újrafelszívódását azáltal, hogy elnyomja a IIa típusú nátrium-foszfát-transzportert (NaPi-2a) a vesetubulusok apikális, ecsethatárú membránján, és ezzel lezár egy negatív visszacsatolási hurkot a foszfát homeosztázis számára. A D-vitamin ellenszabályozó hormonjaként az FGF23 csökkenti az 1,25-dihidroxi-D3-vitamin szérumszintjét azáltal, hogy elnyomja szintézisét a Cyp27b1 gén expressziójának szabályozásával és elősegíti inaktiválódását a Cyp24 gén expressziójának felfelé szabályozásával, ezáltal bezárva negatív visszacsatolási hurok a D-vitamin homeosztázisra.
4. A foszfát-toxicitás genetikai bizonyítékai
A Klotho vagy az FGF23 hibái megzavarják a foszfát- és D-vitamin homeosztázist fenntartó negatív visszacsatolási hurkokat, ami magas szérum-foszfát- és D-vitamin-szintet eredményez. A magas szérum D-vitamin elősegíti a kalcium bélben történő felszívódását és hiperkalcémiát is kivált. Megjegyzendő, hogy ezt az anyagcsere-állapotot a magas szérum-foszfát-, kalcium- és D-vitamin-szint korai öregedési szindrómával társítja. Valójában a klotho gént eredetileg egér törzsben mutált génként azonosították, amely öröklődött a korai öregedési szindrómától (Kuro-o et al., 1997). A Klotho hiányában szenvedő egereknél több öregedésszerű fenotípus alakul ki, ideértve a rövidített élettartamot, a növekedés retardációját, a hipogonadotrop hipogonadizmust, a gyors thymus atrófiát (Min és mtsai., 2007), a bőr atrófiáját, a sarcopeniát, az érrendszer meszesedését, az osteopeniát (Kawaguchi et al., 1999 )), pulmonalis emfizéma (Ishii és mtsai, 2008; Sato és mtsai, 2007; Suga és mtsai, 2000), kognitív zavar (Nagai és mtsai, 2003), hallászavar (Kamemori és mtsai, 2002), és a motoros idegsejtek degenerációja (Anamizu et al., 2005). Ezeket a fenotípusokat az FGF23 hiányában szenvedő egereknél is megfigyelik (Razzaque et al., 2006).
Ezek a megfigyelések azt sugallják, hogy a foszfát, a kalcium és/vagy a D-vitamin megtartva mérgező lehet, és felgyorsítja az öregedést. Több tanulmány is alátámasztotta ezt az elképzelést. Először is, a D-vitaminhiányos étrend nemcsak a szérum foszfát- és kalciumszintjét állította normális szintre, hanem több öregedésszerű fenotípust is megmentett mind Klotho-hiányos, mind FGF23-hiányos egerekben (Stubbs et al., 2007; Tsujikawa et al., 2003 ). Másodszor: a D-vitamin hatásának eltávolítása Klotho-hiányos és FGF23-hiányos egerekben a Cyp27b1 gén (Ohnishi et al., 2009; Razzaque et al., 2006) vagy a D-vitamin receptor gén (Hesse et al., 2007) megszakításával. a hiperfoszfatémiát, a hiperkalcémiát és a korai öregedési szindrómát is megmentette.
Végül az alacsony foszfáttartalmú étrend megmentette a lerövidült élettartamot és az érrendszeri meszesedést mind az FGF23-hiányos, mind a Klotho-hiányos egerekben (Morishita és mtsai, 2001; Stubbs és mtsai, 2007). Ezek a tanulmányok egyértelmű bizonyítékokat szolgáltattak arról, hogy a Klotho-FGF23 endokrin tengely hibáinak okozta idő előtti öregedési szindróma a foszfát, a kalcium és/vagy a D-vitamin visszatartásából adódik. Meg kell jegyezni, hogy az alacsony foszfáttartalmú étrend megmentette az FGF23- hiányos egerek annak ellenére, hogy tovább növelik az amúgy is magas szérum kalcium- és D-vitamin-szintet (Stubbs et al., 2007), ami arra utal, hogy az öregedés-szerű fenotípusokért elsősorban a foszfát felelős, de nem a kalcium vagy a D-vitamin. Valószínű, hogy az alacsony D-vitamin-étrend és a D-vitamin-aktivitás ablációja megmentette a felgyorsult öregedést a szérum foszfátszint csökkentésével, bár még azt kell meghatározni, hogy a foszfátnak magas szérum D-vitamin- és/vagy kalciumszintre van-e szüksége az idő előtti öregedési szindróma kiváltásához.
5. Foszfát és öregedés
A szervetlen foszfát nemcsak a sejtszerkezet (DNS és membránfoszfolipidek) nélkülözhetetlen alkotóeleme, hanem számos sejttevékenység kulcsfontosságú közvetítője, beleértve az energia-anyagcserét (ATP-termelés) és a kináz-közvetített jelátvitelt. Részt vesz a különféle rendellenességek, például csontbetegségek, érrendszeri meszesedés és krónikus vesebetegségek patofiziológiájában is. Bár keveset tudunk a foszfát öregedésre gyakorolt közvetlen hatásairól, a halmozott bizonyítékok azt mutatják, hogy a szervetlen foszfát jelentős hatással van a glükóz anyagcseréjére és az oxidatív stresszre, amelyek potenciálisan befolyásolhatják bármely szervezet öregedési folyamatait az élesztőtől az emberig.
A Saccharomyces cerevisiae-ben a foszfát éhezés, valamint a glükóz éhezés a sejtciklus leállítását és az időrendi élettartam meghosszabbítását indukálja (Boer et al., 2008; Brauer et al., 2008). Számos foszfátra reagáló gént azonosítottak, köztük a PHO85 gént, amely egy ciklinfüggő kinázt kódol, amelynek aktivitása korrelál az intracelluláris foszfátkoncentrációval. A Pho85 alacsony foszfáttartalmú körülmények között inaktiválódik, ami nyugvó G0-szerű állapothoz és hosszabb túléléshez vezet (Wanke és mtsai, 2005). A Pho85 negatív szabályozóként működik egy olyan génkészlet esetében is, amelyeket tipikusan glükóz éhezés indukál (DeRisi és mtsai., 1997; Mouillon és Persson, 2006). Tehát a foszfátkorlátozás metabolikus változásokat idéz elő, hasonlóan az élesztő kalória (glükóz) korlátozása által kiváltottakhoz.
Emlősökben az alacsony foszfáttartalmú étrend az anyagcserében hasonló változásokat okoz, mint az alábbiakban tárgyalt étrendkorlátozás. Az étrend-korlátozás alatt álló állatok csökkentik a vér inzulinszintjét, hogy alkalmazkodjanak a csökkent szénhidrát-hozzáférhetőséghez és megváltoztassák az inzulinra reagáló gének expresszióját, ami a glükóz anyagcseréjében bekövetkező változásokhoz vezet, többek között fokozott glükoneogenezishez és csökkent glikolízishez (Cao et al., 2001; Kayo et al. 2001; Lee és mtsai, 1999; Masoro, 2006; Wetter és mtsai, 1999). Bár az alacsony foszfáttartalmú étrend nem csökkenti a vér inzulinszintjét, valóban megváltoztatja az inzulinra reagáló gének expresszióját az étrend-korlátozás által kiváltotthoz hasonló módon (Xie et al., 1999; Xie et al., 2000), ami megnövekedett glükoneogenezis és csökkent glikolízis. Ez részben azzal magyarázható, hogy az alacsony foszfáttartalmú étrend ismeretlen mechanizmusokkal mérsékelt inzulinrezisztenciát vált ki (Haap és mtsai, 2006; Paula és mtsai, 1998). Így a foszfátkorlátozás által indukált mérsékelt inzulinrezisztencia, valamint az étrend korlátozása által kiváltott hypoinsulinemia gyengíti az intracelluláris inzulinszignál aktivitást, és hasonló változásokat idéz elő az inzulin-reagál gén expresszióban, hasonló metabolikus állapotot eredményezve.
Továbbá az American Heart Association bejelentette, hogy a CKD-t fel kell venni a szív- és érrendszeri betegségek legmagasabb kockázatú csoportjába (Sarnak et al., 2003). Fontos, hogy a CKD-s betegek veséiben a Klotho expresszió jelentősen csökken (Koh et al., 2001). Tehát a CKD egy szegmentális progeroid szindrómának tekinthető, amely Klotho-hiány és foszfát-visszatartás állapotával társul. Érdekes módon a Hutchinson-Gilford progeria szindrómában (HGPS) szenvedő betegek hiperfoszfatémiát és csökkent foszfátkiválasztást mutatnak (Merideth et al., 2008; Ortiz, 2008), amelyek a Klotho vagy FGF23 hiányú egerek jellemző tulajdonságai. Bár a hiperfoszfatémia nem elsősorban felelős a HGPS fenotípusokért, növelheti a kardiovaszkuláris mortalitást a HGPS betegeknél.
Egy másik bizonyíték annak alátámasztására, hogy a foszfát befolyásolja az öregedési folyamatokat, az inverz összefüggés az emlősök hosszú élettartama és a szérum foszfát szintje között (2. ábra). Noha nehézségek adódnak a hosszú élettartam és a „normális” szérumfoszfátszint pontos becslésében, a különböző fajoknál egyértelműen szoros kapcsolat figyelhető meg a hosszú élettartam és a szérumfoszfát között.
- 5 egészségügyi tanulság az olaszoktól - hosszú élettartam LIVE
- Elhízásgátló hatás és antioxidáns aktivitás a magas zsírtartalmú diétás egerekben erjesztett hajdina termékekben
- Elhízásgátló hatás magas zsírtartalmú étrend által kiváltott elhízott C57BL6 egerekben
- A ginzengecet elhízás- és gyulladáscsökkentő hatása magas zsírtartalmú étrendben táplált SpringerLink egerekben
- Meglepő kapcsolat az elhízással