Src-függő, neutrofil-közvetített vaszkuláris hiperpermeabilitás és β-catenin-módosítás
1 Sebészeti és Orvosi Élettani Tanszék, Kardiovaszkuláris Kutatóintézet, Texas A&M Egyetemi Rendszer Egészségtudományi Központ, Temple, Texas 76504
1 Sebészeti és Orvosi Élettani Tanszék, Kardiovaszkuláris Kutatóintézet, Texas A&M Egyetemi Rendszer Egészségtudományi Központ, Temple, Texas 76504
1 Sebészeti és Orvosi Élettani Tanszék, Kardiovaszkuláris Kutatóintézet, Texas A&M Egyetemi Rendszer Egészségtudományi Központ, Temple, Texas 76504
1 Sebészeti és Orvosi Élettani Tanszék, Kardiovaszkuláris Kutatóintézet, Texas A&M Egyetemi Rendszer Egészségtudományi Központ, Temple, Texas 76504
Absztrakt
az érrendszeri endothelium hatékony gátként szolgál az oldott anyagok, a folyadék és a vérsejtek transzvaszkuláris átjutásának szabályozásában. A gátfunkció megváltozása részt vesz a trombogenezisben, az angiogenezisben, a gyulladásban és az ischaemia-reperfúziós károsodásban. A gyulladásos agonisták és sejtek endothel sejtekhez történő kötődése intracelluláris jelátviteli események sokaságát váltja ki, ami az endotheliális permeabilitás növekedését eredményezheti (12, 19, 30, 34). Az aktomiozin-kölcsönhatás összehúzódó erőket generál, amelyek szorosan összekapcsolt endoteliális sejteket széthúznak, ami makromolekuláris kiáramláshoz vezet. A transzmembrán tapadó fehérje, amelyet vaszkuláris endoteliális (VE) -kadherinnek neveznek, endotheliális adherén csomópontokat (AJ) képez, amelyek gátolják a makromolekulák paracelluláris szivárgását. Ha a tapadó és a kontraktilis erők egyensúlya megváltozik, a gát diszfunkciója és szivárgás lép fel.
Korábbi tanulmányok kimutatták, hogy a gyulladásos sejtek egy csoportja, a polimorfonukleáris leukociták (PMN), a sérülés vagy gyulladás helyén tapadnak és vándorolnak át az endotheliumban a környező szövetekbe, és hogy ez a folyamat összefügg a permeabilitás növekedésével (1, 2, 35). Bebizonyítottuk, hogy a PMN által kiváltott hiperpermeabilitás a VE-kadherin és a β-catenin tirozin-foszforilációjának növekedésével egyidejűleg következik be, amelyek a kadherin komplexet az aktin citoszkeletonhoz kötő fehérjecsalád fontos tagjai (14, 16, 27). A közelmúltban a vizsgálatok nyilvánvaló kapcsolatot mutattak ki a β-katenin és az Src-család tirozin-kinázai (Src) között (17). Az Src-kinázokról ismert, hogy szerepet játszanak az endotheliális gát diszfunkció és az angiogenezis jelátvitelében (9., 13., 15., 24.) Az Src aktivitását a tirozin foszforilációja szabályozza a Tyr416-on, amely felszabályozza a kinázt, és a Tyr527, amely kevésbé aktívvá teszi az Src-t (24).
Vegyszerek és gyógyszerek.
Az alkalmazott vegyi anyagok humán rekombináns C5a és fenilarin-oxid (PAO; Sigma), SRCi és PP1 (Calbiochem), poliklonális anti-Src és poliklonális anti-β-catenin (Santa Cruz), poliklonális antiphospho-Src (Tyr416) és ( Tyr527) (sejtjelzés) és poliklonális antifoszfotirozin (transzdukció). Az SRCi [Ac-Tyr (PO3H2) -Tyr (PO3H2) -Tyr (PO3H2) -Ile-Glu-OH] versenyez az SH2-doménekhez való kötődésért (31). Negatív kontroll peptid volt az [Ac-Asp-Ser (PO3H2) -Thr (PO3H2) -Val-Ser (PO3H2) -OH].
A mikrohajók izolálása és perfúziója.
Endoteliális sejtvizsgálatok.
Neutrofil izoláció.
Sertés neutrofileket (PMN) izoláltak a korábban leírtak szerint (27). Az aktiváláshoz a PMN-eket humán rekombináns C5a-nak (10-8 M) tették ki. Az izolált venulakészítményekben PMN-ket adtunk a fúziós fürdőhöz, és HUVEC-vizsgálatok esetén közvetlenül az egyrétegűre adtuk, mindkét esetben 106/ml koncentrációban. Korábbi tanulmányok kimutatták, hogy a C5a a neutrofilfüggő utakon keresztül befolyásolja az endothel működését, de önmagában nem befolyásolja a permeabilitást (27).
Fehérje transzfekció.
A venulák SRCi-vel történő transzfektálásához az edényeket 1 órán át perfundáltuk a peptiddel 10 μg/ml koncentrációban a poliamin transzfekciós reagens jelenlétében. FordIT-LT1 (PanVera) 10 μl/ml koncentrációban. Korábbi transzfekciós vizsgálatok zöld fluoreszcens fehérjét és különféle gátló peptideket használva bebizonyították, hogy ez megfelelő módszer a fehérjék/peptidek intakt mikrohullámokba történő bevezetésére (28). Ezenkívül a FordAz IT-LT1 önmagában nincs nyilvánvaló hatással a mikrovaszkuláris permeabilitásra vagy a vazoreaktivitásra (28). HUVEC transzfekcióhoz az SRCi és FordAz IT-LT1-et azonos koncentrációban adtuk a sejtközeghez, és a transzfekciót 1 órán át hagytuk folytatni. Korábbi vizsgálatok kimutatták, hogy az endothelsejtek sikeres fehérje transzfekcióját alkalmazzák ezzel a technikával (26).
Adatelemzés.
Az immunblot-vizsgálatokban a Western blotok reprezentatív képét választották meg bemutatásra. Minden beavatkozáshoz legalább három ismétlést hajtottak végre, és a fehérje sávok optikai sűrűségét átlagolták. A varianciaanalízist alkalmaztuk a csoportok közötti különbségek jelentőségének értékelésére az immunblot elemzésekben és a permeabilitási vizsgálatokban. Értéke P 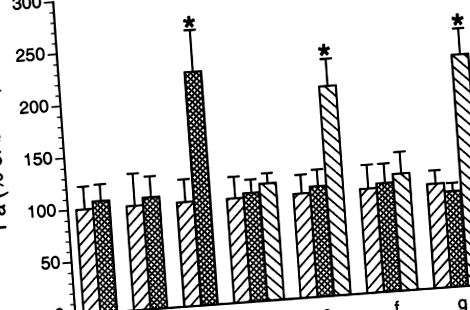
ÁBRA. 1.Polimorfonukleáris leukociták (PMN) által indukált venuláris hiperpermeabilitás. A venulákat perfúzióval albumin-fiziológiai sóoldattal (APSS) végeztük, és az albumin (Pa) bazális permeabilitási együtthatóját 1 óra időtartam alatt meghatároztuk (mindegyik csoport első oszlopa). Az eredményeket a bazális százalékában fejezzük ki. A kezelések a következők voltak: a: nem aktivált sertés PMN (10 6/ml),b: C5a (10–8 M), c: C5a aktiválta a PMN-t, d: SRCi-t transzfektáltunk 1 órán át, majd C5a-aktivált PMN-t, e: negatív kontroll peptid 1 órán át transzfektálva, majd C5a-aktivált PMN, f: PP1 (10-6 M), amelyet C5a aktivált PMN követ, és g: DMSO (0,05%), majd C5a-aktivált PMN. Az értékek átlag ± SE. * A bazális permeabilitás jelentős növekedése,P
PMN által kiváltott hiperpermeabilitás a tenyésztett endoteliális sejtekben.
Annak megállapítására, hogy az endothelsejtek egyrétegűinek permeabilitási válasza összhangban van-e az ép venulákéval, a HUVEC-ket aktivált PMN-eknek tették ki SRCi-vel vagy negatív kontroll peptiddel történő transzfekció vagy PP1-nek való kitettség után. Amint az a 2. ábrán láthatób, az aktivált PMN-ek szignifikáns hiperpermeabilitási válaszokat indukáltak a kontroll szint felett. Ezenkívül az aktivált PMN-ek centrifugálása után kapott felülúszó hasonló hatással volt a permeabilitásra (2. ábrac). Az SRCi azonban teljesen megszüntette ezeket a permeabilitási növekedéseket (2. ábrae). A negatív kontroll peptid transzfekciója nem blokkolta a PMN által kiváltott hiperpermeabilitást (2. ábrag). Az SRCi hatásával egyetértésben a PP1 blokkolta a PMN által kiváltott túlnyúló képességet is (2. ábraén), míg a jármű DMSO-nak nem volt hatása (2. ábrak).
ÁBRA. 2.Hiperpermeabilitási válasz az emberi köldökvénás endothelsejtekben (HUVEC). A kezelések a következők voltak: a: vezérlés, b: C5a-aktivált sertés PMN (106/ml),c: felülúszó az aktivált PMN-ből, d: SRCi,e: SRCi, majd aktivált PMN, f: negatív kontroll peptid, g: negatív kontroll peptid, majd aktivált PMN, h: PP1 (10-6 M), én: PP1 (10-6 M), majd aktivált PMN, j: DMSO (0,05%), és k: DMSO, majd aktivált PMN. A Pa-t 30 perc múlva mértük, és az eredményeket a kontroll százalékában fejeztük ki. Az értékek átlag ± SE. * A permeabilitás jelentős növekedése, P
Szív tirozin foszforilációja.
Amint azt korábban említettük, az Src egy tirozin-kináz, amelyet önmagában tirozin-foszforilezés szabályoz. HUVEC-ek segítségével megmutatjuk, hogy az aktivált PMN-ek és a PAO (tirozin-foszfatáz inhibitor) S4 foszforilációt indukálnak Tyr416-on (3. ábraA,sávok 4 és 7), amely feltételezhetően aktiválja az Src-t. Ezt a Tyr416 foszforilációt olyan sejtekben csillapítottuk, amelyeket SRCi-vel transzfektáltunk (3. ábraA, sávok 6 és8.). 3. ábraB, sávok 4 és7, azt mutatja, hogy amikor az Src-t PMN-ek vagy PAO aktiválják, a Tyr527-nél a foszforiláció csökken. Három különböző kísérletből származó sávintenzitást pásztázó densitometria alkalmazásával, majd a National Institutes of Health képszoftverrel történő kvantálásával nyertük. Ezek az adatok azt mutatták, hogy az Src Tyr416 és Tyr527 foszforilációs változásai az aktivált PMN-ekre és a PAO-ra adott válaszban jelentősen különböznek a kontroll szintjétől (3. ábra,D és E). Úgy tűnik, hogy a sejtekben jelen lévő Src mennyisége egyik vizsgálati körülmény között sem változik jelentősen (3. ábraC).
ÁBRA. 3.Src foszforiláció HUVEC-ekben. A kezelések a következők voltak: 1: vezérlés, 2: C5a (10–8 M), 3: PMN (10 6/ml), 4: C5a-aktivált PMN (106/ml), 5.: SRCi transzfektálva 1 órán át,6.: SRCi, majd aktivált PMN (10 6/ml),7: fenilarin-oxid (PAO) (10-8 M), és8.: SRCi, majd PAO (10-8 M). A kezeléseket 10 percig végeztük. A sejtek lízise után minden kezelésből 10 μg fehérjét vetünk alá Western elemzésnek 6% PAGE gélen. Az alkalmazott antitestek a következők voltak: A: anti-phospho Src (Tyr416), B: anti-phospho Src (Tyr527), és C: anti-Src. D és E: zenekarok A ésB, denzitometriával és Src Tyr416 (D) és Tyr527 (E) a foszforilezést a kontroll százalékában fejeztük ki. Ezeket a kísérleteket háromszor megismételtük. Az értékek átlag ± SE. *P
Src aktiváció és β-catenin.
ÁBRA. 4.β-catenin lokalizáció HUVEC-ben. A: kontroll sejtek;B: C5a-aktivált PMN-nek kitett sejtek; C: felülúszó C5a-aktivált PMN-ből; D: PP1 (10-6 M), majd aktivált PMN; E1 órán át transzfektált SRCi; F: SRCi, amelyet C5a-aktivált PMN követ; G: C5a-aktivált PMN-expozíció, PBS-sel mossuk, 1 órán át visszatesszük a teljes táptalajba; és H: negatív kontroll peptid, amelyet C5a-aktivált PMN követ. Rögzítés és permeabilizálás után a sejteket anti-β-catenin primer antitesttel, majd FITC-konjugált szekunder antitesttel inkubáltuk. Vegye figyelembe a résképződést és a β-catenin elvesztését azokon a helyeken, ahol a sejtek elvesztették a kapcsolatot B,C, és H.
ÁBRA. 5.PMN-indukálta Src/β-catenin asszociáció HUVEC-ben. MertA és B, kezelések a következők voltak:1: vezérlés, 2: C5a-aktivált PMN (106/ml), és 3: SRCi-t transzfektáltunk 1 órán át, majd C5a-aktivált PMN (106/ml). 10 percig tartó PMN-kezelés után 100 μg fehérjét használtunk fel az Src immunprecipitációhoz. Az immunprecipitátumokat Western-analízisnek vetettük alá, és megvizsgáltuk a β-katenin (A) vagy Src (B). MertC, D, és E, kezelések a következők voltak: 1: vezérlés, 2: C5a-aktivált PMN (106/ml), 3: 1 órán át transzfektált SRCi, majd C5a-aktivált PMN (106/ml) és 4: SRCi transzfekció. 10 percig tartó PMN-kezelés után 100 μg fehérjét alkalmaztunk β-katenin immunprecipitációra, majd foszfotirozin immunoblottingot (C) vagy foszfotirozin immunprecipitáció, amelyet β-catenin immunoblotting követ (D). Ban ben E, 15 μg teljes sejtfehérjét használtunk fel a β-catenin immunblotoláshoz.
Korábbi vizsgálataink kimutatták a PMN-ek végleges hatásait a vaszkuláris endotheliumra mind az intakt mikrovérek, mind a tenyésztett sejtek felhasználásával, amelyekben az aktivált PMN-ek az AJ fehérjék foszforilációját és konformációs változásait okozzák az intercelluláris résképződéssel összefüggésben (27, 35). A PMN adhézió és az AJ változás között bekövetkező jelzési eseményeket azonban nem ismerjük jól. Ez a tanulmány először kapcsolja össze a jól ismert Src jelátviteli utat ezekkel a folyamatokkal. Tudjuk, hogy a hat funkcionális doménnel rendelkező Src tirozin-kinázokat illetően a Tyr527 foszforilezése, valamint az SH2 és SH3 domének közötti kölcsönhatások stabilizálják az Src inaktív formáját (21). Ezzel szemben a Tyr416 foszforilezése a kináz domén aktiváló hurkában aktiválja az Src-t (21). Mások a vaszkuláris endotheliális növekedési faktorra adott válaszként Src-követelményt mutattak az érpermeabilitásra (9). Eredményeink egyértelműen azt mutatják, hogy a PMN által kiváltott hiperpermeabilitás mind a mikrovérekben, mind az endoteliális sejtekben nagymértékben csillapítható az Src gátlás révén. Az aktivált PMN-ek fokozták az Src Tyr416 foszforilációját és csökkentették a Tyr527 foszforilációját, két olyan eseményről, amelyekről ismert, hogy felpörgetik az Src aktivitását. Ezek a megállapítások arra utalnak, hogy az Src a PMN által közvetített endotheliális gát diszfunkciójának fő összetevője.
A PMN adhézió után mikrovaszkuláris szivárgáshoz vezető pontos molekuláris mechanizmusok nem egyértelműek. Az endoteliális monorétegekkel végzett korábbi vizsgálatok kimutatták, hogy az aktivált PMN-ek aktin stressz rostképződést váltanak ki, ellentétben a nem stimulált sejtekkel, amelyekben a filamentális aktin nagy része a sejtperiférián található (27). Nyilvánvaló, hogy ezek a szálak érintkeznek a sejtmembrán ellentétes oldalaival, és sejtösszehúzódást váltanak ki, amely megszakítja a sejtek közötti érintkezést és résképződéshez vezet. Hipotézisünk az, hogy az AJ fehérjék kölcsönhatásba lépnek az aktin stressz szálakkal, és ez a kölcsönhatás az AJ dezorganizálódásához és a sejtmorfológia változásaihoz vezet. A β-katenin foszforilezése, amelyről ismert, hogy a VE-kadherint összekapcsolja az aktin citoszkeletonnal (14), kulcsfontosságú jelző esemény lehet, amely az ilyen strukturális változásokat irányítja. A β-catenin tirozin foszforilezésének javasolt mechanizmusa AJ dezorganizációban párhuzamos a Wnt/β-catenin jelátviteli folyamattal, amelyben a Wnt stabilizálja a β-catenint azáltal, hogy blokkolja szerin/treonin foszforilációját és ezt követõen a lebomlást célozza, ami β- catenin nukleáris lokalizáció és transzkripciós aktiváció (23). Ezzel szemben a Wnt hiánya β-katenin szerin/treonin foszforilációhoz és proteazomális lebomláshoz vezet (18).
Ennek a tanulmánynak az egyik célja az volt, hogy megkísérelje az aktivált PMN-eket korrelálni egy β-katenint tartalmazó jelátviteli úttal, amely az AJ komponensek megváltozásához vezet. Ez a tanulmány kimutatta, hogy PMN-stimulált körülmények között a β-katenin koimmunoprecipitálódott Src-vel. Ez a látszólagos Src/β-catenin asszociáció teljesen blokkolódott, amikor a sejteket SRCi-vel transzfektálták. Ezenkívül be tudtuk mutatni, hogy a PMN által indukált β-catenin tirozin foszforilációja blokkolt az Src gátlás körülményei között a tenyésztett endoteliális sejtekben. Ezek az eredmények együttesen azt sugallják, hogy az Src és a β-catenin kölcsönhatásra és foszforilezésre van szükség a PMN által kiváltott hiperpermeabilitáshoz. Talán az Src kináz az, amely közvetlenül foszforilálja a β-katenint az aktivált PMN-ekre reagálva; ez az esemény az AJ rendezetlenségéhez és végső soron az endotheliális gát diszfunkciójához vezet. Nyilvánvaló, hogy az Src és a β-catenin több sejtes folyamatban vesz részt, és további vizsgálatok megkísérlik megérteni a két fehérje közötti kapcsolatot és kölcsönhatásukat a mikrovaszkuláris endothelium gát integritásának központi elemével.
Ezt a munkát támogatta a National Heart, Lung and Blood Institute Grants HL-61507 és HL-70752 támogatás (S. Y. Yuan számára) és egy VA VISN 17 támogatás (J. H. Tinsley-nek). S. Y. Yuan a K02 HL-03606 Országos Egészségügyi Kutatóintézet Karrier Díj címzettje.
LÁBJEGYZETEK
Az újranyomtatási kérelmek és egyéb levelezések címe: J. H. Tinsley, Osztály orvosi élettan, Texas A&M Univ. System Health Science Center, 702 SW HK Dodgen Loop, Rm. 206F, Temple, TX 76504 (E-mail: [email protected] edu).
- Kismedencei torlódás szindróma - csendes-óceáni érrendszeri
- Különös, de igaz, hogy túl sok vizet is megölhet - Scientific American
- Stroke Connection és hírek az American Stroke Association
- Oroszország visszatartotta egy gyengélkedő amerikai katonai attasét, hogy elhagyja Moszkvát - The New York Times
- Gyógyszerész által irányított fogyókúrás program étkezést helyettesítő termékkel American Journal of