Táplálkozási források
Kémiai Szemle
A fehérjék a makromolekulák harmadik fő csoportja, amelyek az organizmusok testét alkotják. A fehérjék sokféle szerepet játszanak az élőlényekben. A legfontosabb fehérjék talán az enzimek, a specifikus kémiai reakciók felgyorsítására képes fehérjék. Más rövid fehérjéket, peptideket, kémiai hírvivőként használnak az agyadban és az egész testedben. A kollagén, egy szerkezeti fehérje, fontos része a csontoknak, a porcoknak és az inaknak. Változatos funkcióik ellenére minden fehérjének ugyanaz a bázikus szerkezete: hosszú aminosavlánc kapcsolódik egymáshoz.
Az aminosavak olyan kis molekulák, amelyek egy aminocsoportot (- NH2), egy karboxilcsoportot (- COOH), egy hidrogénatomot, egy szénatomot és egy aminosavakban eltérő oldalláncot tartalmaznak. Az általánosított képletben
aminosav, az oldallánc R-vel van feltüntetve. Az egyes aminosavak azonosságát és egyedi kémiai tulajdonságait az R-csoport jellege határozza meg.
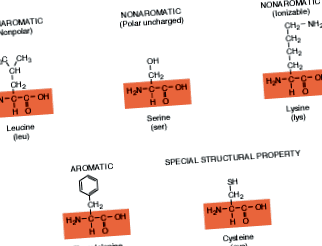
Csak 20 különböző aminosav alkotja az élőlényekben található fehérjék sokféleségét. Minden fehérje különbözik a szerkezetét alkotó aminosavak mennyiségétől, típusától és elrendezésétől. Figyelje meg, hogy mindegyiknek ugyanaz a kémiai gerince (amelyet a doboz mutat), mint az általánosított képletben. Az R csoportok ezeken a dobozokon kívül vannak. Azokat az R csoportot tartalmazó aminosavakat, amelyek gyűrűs szerkezetet képeznek, aromás vegyületeknek nevezzük, a gyűrűs szerkezettel nem rendelkezőeket pedig nem aromás vegyületeknek. (Ezt a kifejezést azért hozták létre, amikor a kémikusok felfedezték, hogy sok illatos vegyület rendelkezik ezzel a jellegzetes gyűrűszerkezettel.) Azok az ionizálható aminosavak R-csoportokkal rendelkeznek, amelyek oldatban töltődnek fel.
15. ábra: A polipeptidlánc kialakulása és elszakadása. (a) A dehidratációs szintézis során peptidkötések jönnek létre a szomszédos aminosavak között, polipeptidet képezve. (b) A hidrolízis során minden peptidkötéshez vízmolekulát adnak, amely összeköti a szomszédos aminosavakat, megszakítva a köztük lévő kötést. Ez a molekulákat külön aminosavakra választja szét.
16. ábra Az elsődleges szerkezet meghatározza a fehérje alakját a lánc mentén történő kötődés miatt.
A polipeptidláncban lévő aminosavak funkcionális csoportjai kölcsönhatásba lépnek szomszédaikkal, hidrogénkötéseket alkotva. Ezenkívül a sok nem poláros oldallánccal rendelkező proteinlánc egy részét hidrofób tulajdonságai miatt általában be kell tolni a fehérje belsejébe. Ezen kölcsönhatások miatt a polipeptidláncok hajlamosak spontán lapokra hajtani vagy tekercsekké tekerni. Ezt a hajtogatott vagy tekercselt alakot másodlagos szerkezetének nevezzük. A nagyrészt lapokból álló fehérjék gyakran olyan szálakat képeznek, mint a keratin szálak a hajban, a fibrin a vérrögökben, és a selyem a pók hálójában. Azok a fehérjék, amelyeknek tekercseket képező régiói vannak, gyakran gömb alakúvá válnak, például a vér hemoglobin globin alegységei.
A hidrogénkötés a másodlagos szerkezettel bonyolultabb formájú fehérjéket is eredményezhet. A szerkezet következő szintjét harmadlagos szerkezetnek nevezzük. Azoknál a fehérjéknél, amelyek alegységekből (különálló polipeptidláncokból) állnak, ezt az alegységet egésszé állítják össze, ezt kvaterner szerkezetnek nevezzük. 4.
- Omni táplálkozási szelvény - 122020
- NEM GMO-TÁMOGATÁS; Elképesztő táplálék
- Férfiak; s szexuális egészség A táplálkozás, az alacsony tesztoszteron közötti kapcsolat; Merevedési zavar
- Férfiak; s Egészségügyi hét - Táplálkozás és hidratálás - Egész völgyben zajló egészség
- Férfiak; a Fitness Sports Nutrition Awards 2018 díjjal