A noradrenerg átvitel reboxetin általi stimulálása előnyös a progresszív parkinsonizmus egérmodelljében
Tárgyak
Absztrakt
Bevezetés
A Parkinson-kór (PD) a második leggyakoribb neurodegeneratív rendellenesség, amely az idős populációk (> 65 év) legfeljebb 3% -át érinti. A PD-t olyan motorhiány jellemzi, mint remegés, merevség és bradykinesia 1. Ezeket a tüneteket leginkább a substantia nigra (SN) és a ventrális tegmentális területen (VTA) található dopaminerg neuronok elvesztése okozza. Mivel a PD esetek több mint 90% -a szórványos eredetű, a betegség kezelésében kevés előrelépés történt. Az elmúlt 40 évben a kutatók a dopaminerg transzmisszió farmakológiai fokozására összpontosítottak, amelyet általában akkor hajtanak végre, amikor a neuronok többsége már eltűnt.
Ez a tanulmány annak megértésére irányult, hogy a noradrenerg transzmisszió farmakológiai fokozása akár szelektív NA újrafelvétel-gátló (reboxetin, REB), akár egy alfa2-AR antagonista (atipamezol, APM) krónikus alkalmazásával javíthatja-e a dopaminerg neuronok progresszív veszteségének motoros hatásait és hogy ez a noradrenerg stimuláció jótékony hatással lehet-e a dopaminerg idegsejtek túlélésére és a striatális dopamin tartalmára a progresszív parkinsonizmus egérmodelljében.
Ennek a hipotézisnek a teszteléséhez egy feltételes knock-out egérmodellt használtunk, amelyből hiányzik az IA transzkripciós iniciációs faktor (TIF-IA), amelyet egy alapvető sejtfunkció indukálható gátlása jellemez, például dopaminerg idegsejtekben az rRNS szintézis a progresszív neurodegenerációjuk kiváltására 11 . Ezek a mutáns egerek utánozzák a PD számos jellegzetességét, beleértve az SN idegsejtek progresszív és szelektív sebezhetőségét, motoros koordinációs hiányokat, valamint fokozott mitokondriális diszfunkciókat és fokozott oxidatív stressz károsodásokat 11. Fontos, amint azt korábban bemutattuk, ennek a mutációnak néhány hatása részben megmenthető az L-DOPA 11 alkalmazásával, valamint a pro-apoptotikus jelátviteli utak, például a p53, gátlásával és a fehérjeszintézis mesterszabályozójának, a mechanisztikus célzásnak a fokozásával. a rapamicin (mTOR) 11,12, támogatva azok esetleges alkalmazását a dopaminerg neurodegeneráció elleni betegségmódosító terápiák modelljeként.
Anyagok és metódusok
Állatok
A TIF-IA szelektív ablációját dopaminerg neuronokban (TIF-IA DATCreERT2 egerek) a Cre/loxP megközelítés. Transzgenikus egerek befogadása Cre a dopamin transzporter (DAT) promóter (DAT CreERT2 egerek) alatti rekombinázt kereszteztük a floxolt TIF-IA gént hordozó állatokkal, amint azt korábban leírtuk 11. A hím és nőstény mutáns egereket azonos nemű kontroll (Cre-negatív) alomtársaikkal önszellőztetett ketrecekben, standard laboratóriumi körülmények között (12 órás világos/sötét ciklus, táplálék és víz) tartottuk. ad libitum). A vizsgálatot szigorúan az Országos Egészségügyi Intézet laboratóriumi állatok gondozásának és felhasználásának útmutatójában szereplő ajánlásoknak megfelelően végezték el. Az összes viselkedési vizsgálat protokollját a Lengyel Tudományos Akadémia Farmakológiai Intézetének Állatetikai Bizottsága hagyta jóvá (Engedélyszám: 951/2012, kiállítva: 2012.06.28.).
Kábítószerek és kísérleti ütemterv
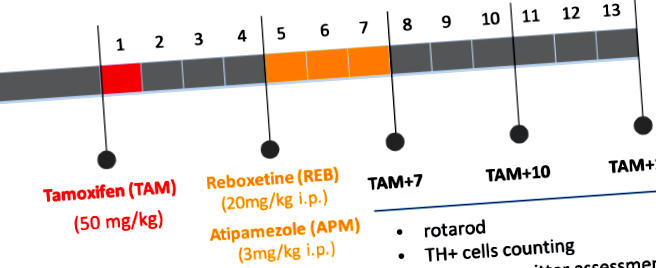
A tamoxifen-függő CreERT2 rekombináz aktiválásához felnőtt (12 hetes) egerekben és a mutáció kiváltásához tamoxifent (TAM) (Sigma-Aldrich, USA) olajos oldatban alkalmaztunk 1 mg/egér dózisban, napi 2x 5 egymást követő napokban, 4 héttel a vizsgált gyógyszerek beadása előtt. A kontroll (w/t) állatok csak olajat kaptak. Reboxetint (REB) (Tocris Bioscience, USA) és atipamezolt (APM) (Antisedan, Orion Pharma, Lengyelország) adtunk be naponta egyszer 21 egymást követő napon, 20 mg/kg, illetve 3 mg/kg dózisban. A kontroll csoportok 0,9% NaCl-ot kaptak. Az összes viselkedési és biokémiai elemzést 7, 10 és 13 héttel végeztük a TAM injekciók után (TAM + 7, TAM + 10, TAM + 13), amint az a 7. ábrán látható. 1.
A kísérleti tervet összefoglaló folyamatábra. TAM - tamoxifen, REB - reboxetin, APM - atipamezol; TAM + 7, TAM + 10, TAM + 13: 7, 10, 13 hét a mutáció kiváltása után (tamoxifen alkalmazása).
Rotarod teszt
A rotarod tesztet a motoros koordináció értékelésére végeztük. A tesztet gyorsított rotarodon (Ugo Basile, Olaszország) végeztük. Az értékelést egy nappal az első kísérlet előtt egy edzés előzte meg (5 perc a forgórúdon állandó sebességgel). A tamoxifen injekciót követően a 7., 10. és 13. héten végzett kísérleti munkák során megmértük a gyorsító rúdra fordított időt (4–40 fordulat/perc 5 percen belül).
HPLC elemzés
Immunhisztokémia
Az eljárást a korábbiakban leírtak szerint hajtották végre 14, néhány módosítással. Röviden, az agyakat eltávolítottuk, 48 órán át fixáltuk 4% paraformaldehidben (PFA), leöblítettük és 0,4% PFA-ra helyeztük át. Rögzítés után az agyakat egy vibratómán (Leica, Németország) 30 μm-es szakaszokra vágtuk. A középagy agyszelvényeit, beleértve az SN/VTA-t, egy éjszakán át inkubáltuk 4 ° C-on primer tirozin-hidroxiláz (TH) (1: 500, Millipore, USA, kat. AB1542) antitesttel. Az antigénhez kötött primer antitestek vizualizálását megfelelő biotinilezett szekunder antitest alkalmazásával végeztük, majd inkubálást végeztünk az Avidin/Biotin Complexszel (ABC; Vector Laboratories, USA) és diaminobenzidinnel (DAB; Sigma, USA). A festett részeket fénymikroszkóppal (Nikon Eclipse50i, Japán) fényképezőgéppel és NIS Elements szoftverrel elemeztük. A TH-pozitív sejtek (TH +) mennyiségi meghatározását manuálisan végeztük, minden vakcinázás nélküli kísérlet során minden egyes genotípus/kezelés 6 állatának szomszédos szakaszain az összes TH + sejtet megszámoltuk.
Elsődleges embrionális középagy sejtkultúrák és gyógyszeres kezelés
Statisztikai analízis
A statisztikai elemzést Graph Pad Prism 7 szoftverrel végeztük. Az adatokat kétirányú varianciaanalízissel (2-utas ANOVA, genotípus × kezelés) értékeltük, biológiailag releváns csoportok többszöri összehasonlításával (figyelembe véve az elemzés 3 különböző időpontját), majd Fisher LSD post hoc tesztjét. A 0,05 alatti P-értékeket statisztikailag szignifikánsnak tekintettük.
Eredmények
Reboxetin-enyhített motoros károsodás kezelése a TIF-IA DATCreERT2 egerekben
Amint azt az 1. és 2. ábra szemlélteti. Az 1. ábrán TAM-injekcióval indukáltuk a TIF-IA feltételes ablációját, és 4 héttel a TAM után megkezdtük a 21 napos kezelést REB-vel vagy APM-mel, a TAM által kiváltott hatékony rekombinációhoz szükséges idővel. Annak megvizsgálására, hogy a REB vagy az APM pozitívan befolyásolhatja-e a TIF-IA DATCreERT2 egerek dopaminerg neuronjainak progresszív elvesztése által kiváltott motorhiányt, három különböző időpontban (7, 10 és 13 héttel a TAM után) teszteltük a kontroll és mutáns állatokat. (TAM + 7, TAM + 10 és TAM + 13) rotaroddal. Korábbi kísérletek alapján ezek a szakaszok korábban progresszív parkinsonizmushoz vezettek, kezdve a TAM + 7-től (sejthullás nélkül) és súlyos viselkedési fenotípusban fejlődve mélységes dopaminerg degenerációval társult a TAM + 13 11-nél. Amint az várható volt, a VEH-val kezelt TIF-IA DATCreERT2 egerek az állóképesség jelentős csökkenését mutatták ki (57,7% -kal, szemben a kontroll, VEH-val kezelt állatok, kétirányú ANOVA: F genotípus F (2218) = 12,63; p 2. ábra
A reboxetinnel végzett kezelés növelte a DA neuronok túlélését a TIF-IA DATCreERT2 egerekben
A REB-kezelés dopaminerg idegsejtek túlélésére gyakorolt javasolt jótékony hatásának további vizsgálatához immunfestést végeztünk a TH + sejtek SN és VTA régiójában történő azonosítására (3. ábra), amely megerősítette a kezdeti viselkedési megfigyeléseket. Különösen a REB-vel kezelt TIF-IA DATCreERT2 egerek mutattak kisebb sejtszámvesztést a tamoxifen indukció utáni 10. héten (TAM + 10). A VEH-val kezelt mutáns egereket a TH + sejt közel 50% -os vesztesége jellemezte a kontroll állatokhoz képest, ami szignifikánsan alacsonyabb volt, mint a REB-vel kezelt mutánsoké (49,7% vs 26,9%; kétirányú ANOVA: F genotípus F (3,24) = 84.43; p DATCreERT2 egerek jelentős TH + sejtvesztést mutattak, azonban a VEH-val kezelt állatokban a sejtveszteség valamivel mélyebb volt. Hasonló degenerációs kinetikai mintázatot figyeltünk meg a REB-vel kezelt és a VEH-val kezelt TIF-IA DATCreERT2 VTA-ban egerek (3B, D ábra).
A dopaminerg neurodegeneráció értékelése a TH + sejtek immunfestésével. A (+) képen látható TH + sejtek immunhisztokémiai festéseA) SN és (B) VTA neuronok; (TH) sejtek mennyiségi meghatározása (C) SN és (D) VTA dopaminerg neuronok. A sávok a kontroll százalékát képviselik; TAM - tamoxifen, SAL - sóoldat, REB - reboxetin; TAM + 7, TAM + 10, TAM + 13: 7, 10, 13 nappal a mutáció kiváltása után (tamoxifen alkalmazás). Az adatok az átlag ± SEM; *** p # p DATCreERT2 a megfelelő időpontban; n = 4.
A reboxetin-kezelés hatása a dopamin- és noradrenalin-tartalomra a TIF-IA DATCreERT2 egerek striatumában
Mivel a TAM (TAM + 7) indukció után 7 héttel a motoros teljesítmény és a TH + sejtek számlálási paraméterei között nem volt különbség a kísérleti csoportok között, a mutáns egerek korlátozott elérhetősége miatt a következőkre koncentráltunk: TAM + 10 és TAM + 13 a REB dopamin (DA) szintre gyakorolt jótékony hatásainak további vizsgálatához a TIF-IA DATCreERT2 egerek striatumában. Ahogy az várható volt, a mutáció 13 héten keresztül a tamoxifen indukció (TAM + 13) után minden állatban jelentős DA kimerülést okozott (kétirányú ANOVA: F genotípus F (1,39) = 21,86; p DATCreERT2 egerek a tamoxifen indukció után 10 héttel) ( A TAM + 10) szignifikánsan eltérő DA tartalommal rendelkezett, a gyógyszeres kezeléstől függően (kétirányú ANOVA: F pont (3,39) = 72,8; p 4. ábra
A (A) dopamin (DA),IDŐSZÁMÍTÁSUNK ELŐTTmetabolitjai (DOPAC, HVA), ésD) noradrenalin (NA) szintje. A sávok az egyes neurotranszmitterek vagy metabolitjaik tényleges értékét mutatják pg/mg szövetben; TAM - tamoxifen, SAL - sóoldat, REB - reboxetin; TAM + 10, TAM + 13: -10, 13 nappal a mutáció kiváltása után (tamoxifen alkalmazás). Az adatok az átlag ± SEM; *** p ## p # p DATCreERT2 a megfelelő időpontban; n = 6.
Az alfa1-adrenerg agonista fenilefrin túlélési potenciált mutatott ki az elsődleges embrionális középagy sejtkultúrában
Annak a hipotézisnek a tesztelése, hogy a noradrenerg stimuláció megfigyelt jótékony hatásai lehetnek-e önmagában egy neuroprotektív potenciált, amelyet valószínűleg az alfa1-AR közvetít, további vizsgálatot hajtottunk végre in vitro kísérlet a w/t C57Bl/6J egerekből származó embrionális középagyi idegsejtek primer kultúráján. A sejteket fenilefrinnel, egy szelektív alfa1-AR receptor agonistával kezeltük. A gyógyszer hozzáadása és a közeg további cseréje nélkül a sejtek az idő múlásával pusztulni kezdtek. A fenilefrin növelte a TH + sejtek túlélését a kezeletlen sejttenyészetekhez képest (5A, B ábra). Ez a hatás hasonló volt a GDNF növekedési faktor alkalmazásához, pozitív kontrollként szolgált. Közelebbről, a fenilefrin tenyésztő táptalajra történő közvetlen alkalmazása szignifikánsan növelte a TH + sejtek túlélését, akár 49% -kal, szemben a nem kezelt sejtekkel, míg a GDNF-kezelés hatékonysága elérte az 58% -ot (5B. Ábra). A REB-kezelés nem mutatott semmilyen hatást a TH + sejtek számára, azonban fontos megjegyezni, hogy a REB főként noradrenerg visszaszívódás gátlóként működik, csak alacsony affinitással rendelkezik az alfa1-AR receptorok iránt.
Vita
Mivel korábbi eredményeink azt mutatták, hogy egyes krónikusan alkalmazott antidepresszánsok, amelyek a noradrenerg transzmisszió fokozásával hatnak, fokozzák az alfa1-AR 19 expresszióját, és a neuroprotektív aktivitásukra 20 utaló adatok fényében, itt úgy döntöttünk, hogy meghatározzuk, hogy a reboxetin, a a nagyon specifikus noradrenerg visszavétel gátló, bármilyen pozitív hatással van a tünetek progressziójának időbeli lefolyására a progresszív parkinsonizmus új modelljében. Ezenkívül kiterjesztettük ezt a vizsgálatot egy másik gyógyszerrel, az atipamezollal, egy alfa2-AR antagonistával, amely fokozhatja a noradrenerg transzmissziót, de más farmakológiai hatásmechanizmussal rendelkezik az alfa2-AR autoreceptorok blokkolásával. Kísérleti állatkísérletek azt sugallják, hogy ez jótékony hatással lehet az agykárosodásból való kilábalásra, és felerősítheti a dopaminerg gyógyszerek parkinson-ellenes hatásait 21 .
Meglepetésünkre a noradrenerg rendszer stimulációjának jótékony hatása inkább a REB-re, nem pedig az APM-re korlátozódott. A gyógyszerrel kezelt TIF-IA DATCreERT2 egerek között a viselkedési jellemzőket a REB, nem pedig az APM javította, amint azt a motor teljesítménye tükrözi a rotarod teszten a TAM + 13-nál (2A, B ábra). A REB-kezelésnek ezek a pozitív hatásai látszólag intracelluláris szinten voltak láthatóak, különösen a TAM + 10-nél, egy olyan szakaszban, amikor a REB-kezelést követően kevesebb csökkent SN-dopaminerg neuront találtunk, és ez ráadásul a REB dopaminszintre gyakorolt jótékony hatásának felel meg. a striatum (3., 4A. ábra).
Mivel a transzgenikus állatok hozzáférhetősége korlátozott, nem lehetett kísérleteket végezni az egyes vegyületek több dózisával. A REB és az APM dózisait azonban saját korábbi tapasztalataink és az ezen gyógyszerek 22,23,24,25,26,27 hatásaival kapcsolatos szakirodalomból jól ismert adatok alapján választottuk meg. Különösen a REB bizonyult nagyon hatásosnak 10 mg/kg 24,27 dózisban, és az APM 3 mg/kg dózisnál 23 fokozta a noradrenerg transzmissziót. Más beszámolók azonban azt mutatják, hogy a különféle alfa2-AR antagonisták eltérő dózisfüggő hatással lehetnek a noradrenerg stimulált viselkedésre 28. Nevezetesen, legalábbis az embereknél az APM mellékhatással járhat a többfeladatos képességek csökkentésében, ami megzavarhatja a sérülékenyebb mutáns állatok képességét a 21-es gyorsított rúd megbirkózásában. Mindazonáltal, a kezdeti viselkedési eredmények alapján, amelyek nem erősítik meg a gyógyszer potenciálját, úgy döntöttünk, hogy további elemzéseket végezünk csak a REB-vel kezelt állatokban és kontroll alomtársaikban.
A REB kezelés motoros viselkedésre gyakorolt lehetséges jótékony hatásait a TIF-IA DATCreERT2 modelljében alátámasztották az SN/VTA idegsejtek veszteségének elemzése, amelyet TH + sejtszámlálás (3A - D. Ábra) szemléltett, különösen az indukció után 10 héttel. a mutáció (TAM + 10) SN-régiójában. Ekkor a VEH-kezelt TIF-IA DATCreERT2 egerekben a TH + sejtvesztés jól látható volt, míg a REB-vel kezelt mutánsokban nem sokban különbözött a kontroll alomtársaktól. Ezenkívül jelentős különbség volt e két csoport között (3C. Ábra). A tamoxifen-indukció (TAM + 13) után 13 héttel mind a REB-vel kezelt, mind a VEH-val kezelt TIF-IA DATCreERT2 egereknél egyértelműen elvesztették a TH + sejteket az SN-ben. Hasonló változások figyelhetők meg a VTA-ban (3D ábra).
Érdekes módon egy korábbi munka kimutatta a REB jótékony hatásait a PD nem motoros tüneteire a 6-hidroxidopamin (6-OHDA) modellben 29. Sőt, az L-DOPA ebben a modellben nem módosította a depressziós és szorongásszerű viselkedést 29. Egyelőre nincs bizonyítékunk a nem motoros tünetekre a TIF-IA DATCreERT2 egerekben, és ezt későbbi kísérletekkel kell kezelni.
Ez az elképzelés összhangban van azzal a megfigyeléssel is, hogy a noradrenerg és szerotonerg rendszereket célzó gyógyszerek (azaz a mirtazapin) terápiásak lehetnek az egerek MPTP neurotoxicitása ellen, esetleg a DA felszabadulás szabályozásával. Ennek a kérdésnek a kezelésére elemeztük halál utáni a DA szintje két időpontban - 10 és 13 héttel a tamoxifen injekciók után. 10 héttel a mutáció (TAM + 10) indukciója után a REB-kezelés differenciált hatásait láthattuk, amint azt a REB-kezelt és a VEH-kezelt TIF-IA DATCreERT2 egerek striatumában található dopamin tartalom mutatja (4A. Ábra)). 13 hét után (TAM + 13) a striatális dopaminszint minden mutánsban hasonló mértékben mélyen csökkent, a gyógyszeres kezelés ellenére (4A. Ábra). Ez nem meglepő, mivel az állatok ebben a szakaszban is kimutatták, hogy a TH + sejtvesztés többé-kevésbé hasonló mértékű (3A - D ábra), és mint már említettük, nagyon valószínűtlen lenne azt várni, hogy a hatások A mutáció hossza hosszabb ideig elhalasztható. Valamennyi, REB-vel kezelt állatot magasabb NA-szint jellemezte, ami magyarázható a krónikus, 21 napos kezeléssel kiváltott hosszú távú változásokkal ezzel a rendkívül szelektív NA újrafelvétel-gátlóval (4D. Ábra).
Összefoglalva megállapíthatjuk, hogy a REB kezelés jótékony hatással lehet a PD-re. Nem világos azonban, hogy ezek a hatások egyszerűen összefüggenek-e a noradrenerg rendszer stimulálására adott válasz adaptív változásával, vagy a noradrenerg stimuláció neuroprotektív tulajdonságával a dopaminerg neuronokon. Ebben a szakaszban nem zárhatjuk ki, hogy a REB-vel kezelt TIF-IA DATCreERT2 egerek javult PD-szerű fenotípusa legalább részben adaptív változásokkal járt 3 hetes gyógyszeres kezelés után és fokozott noradrenerg transzmisszióval. fokozza az izgalmat és az éberséget, és ezáltal javíthatja a forgó kerékkel végzett feladat elvégzésének képességét. Ennek ellenére eredményeink jelzik a noradrenerg rendszer lehetséges hatását a dopaminerg idegsejtekre, és alátámasztják az NA potenciális terápiás célpontját a PD-ben, amit mások is javasoltak 10,40,41 .
Hivatkozások
Poewe, W. et al. Parkinson kór. Nat Rev Dis alapozók 3, 17013 (2017).
Braak, H., Ghebremedhin, E., Rub, U., Bratzke, H. & Del Tredici, K. A Parkinson-kórral kapcsolatos patológia kialakulásának szakaszai. Sejt- és szövetkutatás 318, 121-134 (2004).
- SteelSeries Rival 110, Custom TrueMove1, 7200 CPI, 240 IPS, Prism RGB, vezetékes optikai játékegér
- Rumer Willis drámai fogyókúrás modell mozgatása vagy érzelmi roncsa E! Online
- Bőrápolási tippek Hogyan hasznos a glicerin, a rózsavíz és a citromlé a bőr számára?
- Stefania Dubrovina orosz modellnek féltékeny nővére szúrja ki a szemét
- A nyolcas nő azt mondta, hogy túl kövér ahhoz, hogy a modell végre sikerre találjon, miután három követ szerzett!