Az Orexigen neuropeptidek differenciális válaszai az elhízott anyák utódai éhomi éhínségére
Farmakológiai Tanszék, Orvostudományi Egyetem, Új-Dél-Wales Egyetem, Sydney, Új-Dél-Wales, Ausztrália
Farmakológiai Tanszék, Orvostudományi Egyetem, Új-Dél-Wales Egyetem, Sydney, Új-Dél-Wales, Ausztrália
Farmakológiai Tanszék, Orvostudományi Egyetem, Új-Dél-Wales Egyetem, Sydney, Új-Dél-Wales, Ausztrália
Farmakológiai Tanszék, Orvostudományi Egyetem, Új-Dél-Wales Egyetem, Sydney, Új-Dél-Wales, Ausztrália
Absztrakt
Bevezetés
Az étvágyat egy komplex homeosztatikus hálózat szabályozza, amely központi és perifériás komponenseket tartalmaz az energiamérleg fenntartása érdekében ((1), (2)). A hipotalamust tekintik a perifériás anyagcsere-információk fő integrátorának és feldolgozójának. Az anyagcserét szabályozó jelek áramlása az agyban olyan neuronális interakciókra támaszkodik, amelyek befolyásolják a neurotranszmitterek termelését vagy felszabadulását (3). A hipotalamusz íves magja (Arc) tartalmaz olyan neuronokat, amelyek expresszálják az orexigén peptideket, a neuropeptid Y (NPY) és az agouti-rokon fehérjét (AgRP), valamint azokat, amelyek expresszálják az anorexigén peptid proopiomelanocortin (POMC), valamint a kokain- és amfetamin szabályozott transzkriptumát, amelyek kölcsönhatásba lépnek (1) ). Az adipozitást és az energiamérleget tükröző hormonokból származó bevitel (zsírszármazékból származó leptin és hasnyálmirigy-inzulin) integrálódik a hipotalamuszba az etetés szabályozására.
A mutáns egereken végzett vizsgálatok azt mutatják, hogy az orexigén neuropeptidek túlzott expressziója hozzájárul az elhízáshoz vagy a hiperfág fenotípushoz. Az erős táplálékstimulátor NPY hipotalamusi expressziója többszörösére nő a leptinhiányban ob/ob és leptin receptor hiány db/db egereknél, és mindkét esetben az AgRP túlzott expressziója is megfigyelhető ob/ob és db/db egerek ((4), (5)). A felnőttkori táplálkozási elhízott rágcsálómodelleknél, különösen azoknál, amelyek ízletes étrendet alkalmaznak, nyilvánvaló eltérés mutatkozik a hiperfág fenotípus és az orexigén és anorexigén étvágyszabályozók szintje között. Patkányoknál és egereknél a hosszú távú, magas zsírtartalmú étrend (HFD) táplálkozása indukálta a plazma leptinszintjének jelentős emelkedését, csökkent hipotalamusz NPY-koncentrációval és a POMC, α-melanocita-stimuláló hormon (α-MSH) fokozott peptidhasadási termékével. )) ((6), (7), (8)). Úgy tűnik, hogy ezeknél az állatoknál a hiperfágia nem volt szabályozható ezen alapvető központi szabályozók által.
Az éhség komplex hormonális és idegi reakciót vált ki. Az NPY mRNS expressziója az éhgyomorra vagy a krónikus táplálékkorlátozásra adott válaszként megnövekszik, és 6–24 órán belül csökken ad libitum újratöltés (9), (10), (11), (12), (13)). Az elhízott embereknél az AgRP expressziója is tovább növekszik ob/ob és db/db egerek koplalás közben ((4), (5), (12)). Az éhomi állatokban a POMC mRNS szintje jelentősen csökken, és újratáplálással helyreáll, vagy a leptin exogén beadásával nő (12), (14).
Az elhízás járvány a következő generációt érinti ((15)). Kimutatták, hogy az anyák elhízása hajlamosítja az egyéneket a túlevésre, a fokozott zsírbetegségre és a glükóz intoleranciára (16), (17)). A mögöttes idegi mechanizmusok azonban nem tisztázottak. Korábban csökkent táplálkozási állapotban találtunk csökkent hipotalamusz NPY-t és megnövekedett POMC mRNS-szintet az elhízott gátak utódainál a szülés utáni 20. napon (18), ami hasonló a felnőttkori táplálkozási elhízás változásához (6), (7), (8)). Az éhség az etetési viselkedés fő hajtóereje. Ezért fontos megérteni, hogy az anyai elhízás hogyan befolyásolja ezeknek az étvágyszabályozóknak és hormonoknak az éhségre adott válaszát. Feltételeztük, hogy a hipotalamusz orexigén neuropeptidjeinek növekedése az éjszakai éhgyomorra reagálva nagyobb lenne az elhízott gátak utódainál, mint a sovány gátaknál, ami hyperphagia kialakulásához vezetne.
Módszerek és eljárások
Anyai elhízás
A tenyésztett nőstény Sprague-Dawley patkányokat (8 hét, Animal Resources Center, Canning Vale, Ausztrália) 20 ± 2 ° C-on tartottuk, és 12:12 órás világos/sötét ciklusban tartottuk (a fény 0600 órakor világít). A patkányokat két azonos testtömegű csoportba soroltuk. A kontroll csoportot laboratóriumi chow-val etettük (Gordon's Specialty Stockfeeds, NSW, Ausztrália; 11 kJ/g energia, 14% zsír, 21% fehérje, 65% szénhidrát), a második csoportban pedig ízletes - HFD (15,33 kJ/g, átlagos energia) 34% zsír (telített zsír 17%), 18% fehérje, 50% szénhidrát). A HFD magas zsírtartalmú módosított chow-ból (laboratóriumi chow, tejpor, édesített sűrített tej és telített állati zsír) és nagyon ízletes cafeteria-stílusú élelmiszerekből állt, például húsos pitékből, süteményekből és kekszekből (4-5 különböző típusú naponta). ismert kalóriatartalmú ((6), (7), (18). A nőstény patkányokat 5 hétig etették chow-val vagy HFD-vel, mielőtt párosodtak volna ugyanazon forrásból származó felnőtt hímekkel. A gátak a laktáció alatt ugyanazon az étrenden folytatták. A tanulmányt az Új-Dél-Wales-i Egyetem Állatetikai Bizottsága hagyta jóvá.
Böjt és mintagyűjtés
A gátak normálisan szemeteltek. A születés utáni 19. napon az egyes almokból származó hím kölykök felét 1700 órakor elválasztották anyáiktól, és alomtársaikkal együtt a kezdeti háziketrecük mellett helyezték el őket. Étel nélkül szabadon hozzáférhettek a vízhez. A többi patkány a gátaknál maradt. Másnap reggel az éjszakán át éhező kölyköket 0800–0900 óra között gyűjtötték be, és azokat, akiket nem böjtöltek 0930–1030 óra között. A patkányokat mélyen altattuk (ketamin/xilazin 180/32 mg/kg, intraperitoneális). A naso-anális (N-A) hosszának mérése után a vért szívpunkcióval távolítottuk el, és mértük a vércukorszintet (Accu - Check meter; Roche Diagnostics, Nutley, NJ); a plazmát -20 ° C-on tárolták. A kölyökkutyákat lefejezéssel leöltük, és az egész hipotalamust eltávolítottuk mRNS-mérés céljából a koronális metszeteket követően az optikai chiasmnál és a caudalis hypothalamus sulcusnál. A hipotalamusz területét a hipotalamusz sulci-jához vágva boncoltuk, majd közvetlenül a harmadik kamra fölött. Különböző zsírszöveti ágyakat boncoltak és lemértek, valamint szerveket (szív, máj, vese) és vázizmokat (extensor digitorum longus, soleus és tibialis). A sípcsont hosszát a növekedés markerként mértük.
Tejbevitel és utóvetéses chow bevitel mérése
A tejbevitelt külön csoportban mértük, mivel a kölykök elválasztása anyáiktól mind a gátakat, mind a kölyköket befolyásolhatja. A születés utáni 10. napon a kölykök testtömegét 2 órás elválasztás után rögzítették anyjuktól, és almtársaikkal együtt 31 ° C-on tartották őket. Az anyákhoz való visszatérés után 2 órával regisztrált testsúlynövekedés a tejfogyasztás közvetett mércéje volt, milliliter részegségként kifejezve. Az elválasztás utáni chow bevitelt egy másik 22 napos állatcsoportban (2 nappal az elválasztást követően) mértük egy 24 órás periódus után megmaradt összes táplálék óvatos lemérésével.
Plazmahormon mérések
A plazma leptin és inzulin koncentrációit a kereskedelemben kapható radioimmunoassay készletekkel (Linco, St Charles, MO) mértük. Kiszámítottuk a homeosztázis-modell (HOMA) paraméterét: HOMA = éhomi plazma inzulin (ng/ml) × éhomi plazma glükóz (mmol/l)/(22,5 × 0,0417); minél nagyobb a HOMA érték, annál nagyobb az inzulinrezisztencia szintje (19).
Kvantitatív valós idejű PCR
A teljes hipotalamusz mRNS-t TRIzol reagenssel (Invitrogen Australia, Melbourne, Ausztrália) izoláltuk a gyártó utasításainak megfelelően. A megtisztított teljes RNS-t alkalmaztuk templátként az első szál komplementer DNS-szintézis előállításához M-MLV reverz transzkriptáz, RNáz H-mínusz, Point Mutant Kit (Promega, Madison, WI) alkalmazásával. Az előre optimalizált Applied Biosystem próbákat/primereket (Foster City, CA) használtuk a kvantitatív valós idejű PCR-hez (Eppendorf Realplex 2; Eppendorf AG, Hamburg, Németország). A megcélzott mRNS-t FAM-mal, a 18S rRNS-t VIC-vel jelöltük. A génexpressziót egyetlen multiplexelő reakcióban számszerűsítettük, ahol a kérdéses gént 18S rRNS-re standardizáltuk. Ezután a kontrollcsoport egyedi mintáját önkényesen hozzárendeltük kalibrátorként, amelyhez képest az összes többi mintát hajtjuk végre különbségként.
statisztikai módszerek
Az eredményeket átlag ± s.e.m. A gátak testtömegét és a kölykök HOMA-ját Student párosával elemeztük tTeszt. A többi adatot kétirányú ANOVA, majd ezt követõen elemeztük post hoc Fisher legkevesebb jelentőségű különbségtétele.
Eredmények
Anyai hatás
Az élet első napján az elhízott gátakból született kölykök 10% -kal nehezebbek voltak, mint a sovány gátakból (Asztal 1, P 9 és ötször nagyobb az elhízott gátak kölykeiben. Testtömeg szerint standardizálva ezek a különbségek továbbra is jelentősek maradtak. Az anyák elhízása csekély mértékben befolyásolta az utódok vércukorszintjét és plazma inzulinszintjét (1a, b ábra), míg az elhízott anyák kölykeiben a plazma leptinszintje több mint háromszorosára nőtt (1c. Ábra).
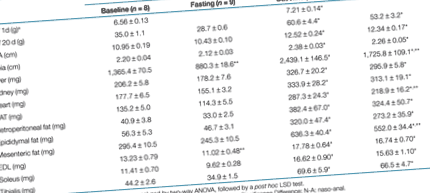 |
Vércukorszint, plazma inzulin és leptin a kiindulási állapotban sovány és elhízott gátak kölykeiben (nyitott rudak), n = 8) és éjszakai éhezés után, n = 8). Az eredményeket átlag ± s.e.m. Az adatokat kétirányú ANOVA-val elemeztük, majd a post hoc LSD teszt. *P
Amikor az állatok táplált állapotban voltak, a hipotalamusz NPY és AgRP mRNS expressziója az elhízott anyák kölykeiben kissé alacsonyabb volt, mint a sovány anyák kölykeiben, anélkül, hogy statisztikai szignifikanciát ért volna el (NPY P = 0,07, 2a, b ábra), míg a POMC mRNS expressziója szignifikánsan megnőtt az elhízott gátak kölykeiben a sovány dámákhoz képest (2c. Ábra). NPY Y1 receptor expresszió (3a. Ábra) nőtt az elhízott anyák kölykeiben, az α-MSH receptor, a melanokortin-4 receptor (MC4R) mRNS expressziójában nem történt jelentős változás.P = 0,07, 3b. Ábra). Az MC4R downstream célpontjának, az egy gondolkodású 1-es génnek (Sim1) az mRNS-expressziója azonban jelentősen, 45% -kal csökkent az elhízott anyák kölykeiben (P
a hipotalamusz mRNS expressziója (a) NPY, (b) AgRP és (c) POMC kölyökkutyáknál az alapvonalban sovány és elhízott gátakból (nyitott rudak, n = 8) és éjszakai éhezés után, n = 8). Az eredményeket átlag ± s.e.m. Az adatokat kétirányú ANOVA-val elemeztük, majd a post hoc LSD teszt. *P
A hipotalamusz NPY Y1 receptorának, az MC4R és a Sim1 mRNS-expressziója a kiindulási állapotban sovány és elhízott dámák kölykeiben (nyitott sávok), n = 8) és éjszakai éhezés után, n = 8). Az eredményeket átlag ± s.e.m. Az adatokat kétirányú ANOVA-val elemeztük, majd a post hoc LSD teszt. *P
A hipotalamusz Ob - Rb és STAT3 mRNS expressziója a kiindulási sovány és elhízott gátak kölykeiben (nyitott sávok), n = 8) és éjszakai éhezés után, n = 8). Az eredményeket átlag ± s.e.m. Az adatokat kétirányú ANOVA-val elemeztük, majd a post hoc LSD teszt. *P
Böjt hatás
Az egynapos koplalás 18, illetve 12% -kal csökkentette testtömegét a sovány és elhízott anyák kölykeiben (Asztal 1). A mintába vett szervek közül csak a májat érintette a koplalás, a sovány és elhízott anyák kölykeiben 35, illetve 30% -kal csökkentek (P
Vita
Az anyák elhízása a gyermekkori elhízás jelentős kockázati tényezője. Humán tanulmányok azt sugallják, hogy az intrauterin faktorok fontosabbak lehetnek a genetikai tényezőknél a HFD-re reagálva a génexpresszió megváltoztatásában, amelynek postnatálisan hosszú távú hatása lehet. Az éhség az étkezési viselkedés fő hajtóereje mind az emberekben, mind az állatokban. Ez a tanulmány megvizsgálta a már meglévő anyai elhízás hatását az utódok központi étvágyszabályozóira és az éjszakai éhgyomorra adott válaszra.
Az anya hosszú távú elhízása nagyobb testtömeghez, testmérethez és súlyosabb zsírbetegséghez vezetett az utódoknál az elválasztáskor, ami összhangban van korábbi megfigyeléseinkkel (18). Ebben a tanulmányban a nagyobb tejfogyasztás 2 óra elválasztás után valószínűleg a megnövekedett éhségnek és nem a stresszel kapcsolatos hatásnak köszönhető, mivel a 8. születés utáni napon az anyai elválasztás jelentős változásokat okozott a kortikoszteronban 8, de nem 4 óra elteltével ((20 )). Így az elhízott utódok kölykeinek gyorsabb súlygyarapodása részben a hyperphagia következménye lehet. Ennek eredményeként a plazma leptin jelentősen megnőtt. Az NPY, az AgRP és a POMC súlyosabb kifejeződése a hipotalamusz íve. A megnövekedett zsírbetegség és a plazma leptin-koncentráció alkalmazkodásaként, amikor az állatok jóllakott állapotban voltak, csak az anorexigén POMC-t szabályozták szignifikánsan az elhízott gátak utódainál, ami hasonló a felnőtt - kezdő táplálkozási elhízott állatoknál megfigyelt változásokhoz ((21) )). Ugyanakkor az Y1 receptor mRNS-t is szabályozták nem gyors állapotban. Mivel az NPY Y1 receptor nemcsak közvetíti az NPY táplálkozási hatásait, hanem szabályozza az energiafelhasználást is ((22)), ez csökkentett energiafelhasználáshoz vezethet telített állapotban.
Az elhízott anyaállatok utódainál az étvágyszabályozók változása a jóllakott állapotban nem elegendő a szoptatási időszakban megnövekedett tejfogyasztás és az elválasztás után hamarosan bevitt energiafogyasztás magyarázatára. Felnőtt patkányokban az NPY koncentrációja étkezés előtt megemelkedik, és az evés során jelentősen csökken, míg az α-MSH ellensúlyozza az NPY-t az etetés gátlásában (28). Ezért össze kell hasonlítani az étvágyszabályozók változását éhes állapotban a sovány és elhízott anyák kölykei között.
A patkányok éjszakai állatok, napi bevitelük nagy részét éjszaka fogyasztják. Éjszakai éhgyomri után a testtömeg, a máj és az izomtömeg, valamint a vércukorszint és a plazma leptin- és inzulinszintje jelentősen csökkent minden kölyöknél. Az éhezés testtömegre gyakorolt hatása összefügg az elválasztási kor növekedési sebességével és az éjszakai táplálás megszakadásával. Mivel a felesleges glükózt glikogénként tárolják a májban és az izomban, és energiahiány idején üzemanyagként használják fel, a csökkent máj- és izomtömeg tükrözheti a tárolt glikogén mozgósítását a minimális glükózszint fenntartása érdekében.
Az Y1 receptort Arc, PVN, laterális hipotalamusz, dorsomedialis és ventromedialis hipotalamusz sejtmag fejezi ki ((33)). Kevés tanulmány méri az Y1 receptor expresszióját, egy jelentés az éhgyomri ívben csökkent Y1 receptor számról, eloszlásról és mRNS expresszióról (34). Ez tükrözheti a regionális különbségeket. Ebben a tanulmányban megmértük a teljes hipotalamusz Y1 receptor mRNS expresszióját, beleértve a PVN-t is, ahol az NPY erőteljes hatást fejt ki a táplálkozásra.
Csökkentett kiindulási Ob - Rb és a downstream STAT3 lehet az első lépés az elhízott állatokban és emberekben általában megfigyelt leptinrezisztencia felé. Valóban bebizonyosodott, hogy az anyák elhízása leptinrezisztenciához vezetett az utódokban még azelőtt, hogy HFD-nek lettek kitéve (38). Ez megmagyarázza, hogy jóllakott állapotban az elhízott gátak utódainak magas leptinszintje nem gátolta-e szignifikánsan az NPY-t és az AgRP-t sem. Bár az éhgyomri után nem változott szignifikánsan az Ob - Rb és a STAT3, az éhgyomorra a plazma leptinszintje még szignifikánsabban csökkent. Mint fentebb említettük, ez hozzájárulhat a megnövekedett NPY és AgRP mRNS expresszióhoz.
Az elválasztáskor a már meglévő anyai elhízás a hipotalamusz orexigén szabályozóinak nagyobb mértékű növekedéséhez vezetett, az anorexigén szabályozók alig reagáltak az éjszakai éhgyomorra, összehasonlítva a sovány gátak utódaival. Ezek a változások közvetlenül hozzájárulhatnak az elhízott gátak utódainak hiperfágiájához és gyorsabb növekedéséhez.
Köszönetnyilvánítás
Ez a munka projekt-támogatást kapott az Ausztrál Nemzeti Egészségügyi és Orvosi Kutatási Tanácstól Margaret Morris számára.
Közzététel
A szerzők nem jelentettek összeférhetetlenséget.
- Az éhomi C-peptid Hasznos eszköz a túlsúlyos elhízottak II. Típusú cukorbetegségének diagnosztizálására
- A károsodott éhomi glükóz gyakorisága II-es típusú cukorbetegek első fokú rokonainál és
- Diétás étkezés a cukorbeteg elhízott betegek kezelésében - MedCrave online
- Gyors kerékpározás Van-e előnye az éhező kerékpárosnak
- Diéta, fizikai aktivitás és viselkedési beavatkozások túlsúlyos vagy elhízott kezelésére