A mitokondriális 2 ′, 3′-ciklikus nukleotid-3′-foszfodiészteráz funkciói és jövőjének kilátásai
Krestinina Olga
1 Elméleti és Kísérleti Biofizikai Intézet, Orosz Tudományos Akadémia, Pushchino, 142290 Moszkva régió, Oroszország; ur.relbmar@luyb
Baburina Yulia
1 Elméleti és Kísérleti Biofizikai Intézet, Orosz Tudományos Akadémia, Pushchino, 142290 Moszkva régió, Oroszország; ur.relbmar@luyb
Papadopoulos Vassilios
2 Farmakológiai és Gyógyszerésztudományi Tanszék, Gyógyszerészeti Iskola, University of Southern California, Los Angeles, CA 90089, USA; ude.csu@podapapv
Absztrakt
A 2 ′, 3′-ciklikus nukleotid-3′-foszfodiészteráz (CNPáz) egy mielinnel társult enzim, amely a 2 ’, 3’-ciklikus nukleotidok foszfodiészter hidrolízisét 2’-nukleotidokká katalizálja. Jelenléte azonban megtalálható a nem myelinizált sejtekben és más sejtszerkezetekben is. Specifikus fiziológiai funkcióinak megértése, különösen a nem myelinizált sejtekben, még mindig nem teljes. Ez az áttekintés a mitokondriális CNPáz (mtCNPáz) szerepéről szól, függetlenül a mielintől. Az mtCNPáz képes szabályozni a mitokondriális permeabilitás átmeneti pórusának (mPTP) működését, és így részt vesz a sejthalál mechanizmusában, mind az apoptózisban, mind a nekrózisban. Felülvizsgálják a különböző betegségek és kóros állapotok, például az öregedés, a szívbetegségek és az alkoholfüggőség kialakulásában való részvételét is. Mint ilyen, az mtCNPáz potenciális célpontnak tekinthető a mitokondriummal kapcsolatos betegségek kezelésében alkalmazott terápiás stratégiák kidolgozásában.
1. Bemutatkozás
Az emlősök és néhány gerinces központi idegrendszerében bőségesen jelen van egy mielinnel társult 2 ′, 3′-ciklikus nukleotid 3′-foszfodiészteráz enzim (CNPáz, EC3.1.4.37). Ismeretes, hogy a CNPáz képes katalizálni a 2 ’, 3’-ciklikus nukleotidok hidrolízisét in vitro 2’-nukleotidok előállítására [1], de az élettani szubsztrát in vivo még mindig nem egyértelmű. Ezenkívül beszámoltak arról, hogy az enzim számos más sejttípusban volt jelen, bár alacsonyabb szinten [2,3], valamint lépből, májból, csecsemőmirigyből, mellékvesékből, vese-, szív- és vázizom [4,5,6]. A CNPázról azt is megfigyelték, hogy a mellékvese sejtekben mitokondriumokkal társult [7].
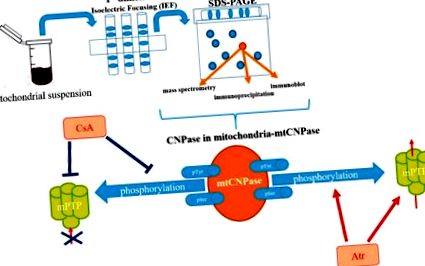
2. Az mtCNPase kimutatása
Az mtCNPáz kimutatásának sematikus ábrázolása a mitokondriumokban.
3. Az mtCNPase interakciós partnerei
Dyer és társszerzők kimutatták, hogy a CNPáz mind az aktin, mind a tubulin alapú citoszkeletekkel együtt lokalizálódott tenyésztett oligodendrocytákban. [21]. Később De Angelis és Braun megállapította, hogy a CNPáz valóban kötődik az aktin alapú citoszkeletonhoz [23]. A CNPáz - tubulin kölcsönhatás további biokémiai bizonyítékát abból a megfigyelésből nyertük, hogy a tenyésztett patkány pajzsmirigy sejtjeiben lévő mikrotubulusok disszociálódtak a plazmamembrántól az izoprenilációt gátló vegyület, lovasztatin kezelés után. Mivel a tubulin működése nem igényel izoprenilezést, ez arra utal, hogy egy izoprenilezett linker fehérjének kell felelősnek lennie a mikrotubulus membránokhoz való kapcsolódásért. Egy ilyen 48 kDa molekulatömegű izoprenilezett fehérjét később CNPázként azonosítottak [24]. Megállapították azt is, hogy a CNPáz nemcsak a tenyésztett patkány pajzsmirigy sejtjeiben és az agyszövetében található mikrotubulusokkal társul, hanem a mikrotubulusokkal együtt tisztul még sikeres polimerizációs és depolimerizációs ciklusok után is. Így a CNPáz mikrotubulusokhoz társuló fehérjeként azonosították, amely in vitro mikrotubulus polimerizációs aktivitással is rendelkezik [25].
Beszámoltak arról, hogy az mtCNPáz specifikusan kapcsolódik az ADAP1-hez, egy agy-specifikus fehérjéhez (a közelmúltban p42 IP4 vagy Centaurin-α1 néven ismert) és az a-tubulinnal az RBM-ben [26]. Érdekes, hogy a mitokondriumokban az ADAP1 és az mtCNPase, az ADAP1 és az a-tubulin közötti, valamint az mtCNPase és az a-tubulin közötti összefüggéseket ko-immunprecipitációs kísérletek igazolták [26]. A koimmunoprecipitáció az adott fehérjék közötti in vivo kölcsönhatások jelzésének tekinthető. Fontos, hogy kiderült, hogy az RBM-ből származó ADAP1 immunprecipitátum immunreaktív sávokat tartalmazott mind az mtCNPáz, mind az a-tubulin antitestek számára. A mielin-alapú CNPáz izoform kontroll antitestekkel kapott immunprecipitátumokban az immunreaktív sávokat nem figyelték meg. Az ADAP1 α-tubulinnal és mtCNPázzal történő együttimmuniprecipitációjának specifitását ANT antitesttel végzett immunfestéssel igazoltuk. Így az ADAP1, mtCNPáz és a-tubulin közötti in vivo komplex képződésére lehet következtetni az RBM-ben. Az ADAP1 és az mtCNPáz szerepét a Ca 2+ által indukált mPTP nyitásban függetlenül igazolták különféle sejtek izolált mitokondriumaiban [16,26]. Ezért nagyon érdekes megérteni, mi a funkcionális következménye az RAP-ban in vivo képződött ADAP1, mtCNPase és α-tubulin komplexnek.
Beszámoltak arról, hogy az mtCNPáz mind a belső, mind a külső mitokondriális membránon lokalizálódik, hatékonyan közéjük helyezve (2. ábra) [16]. Ez a megállapítás arra késztetett bennünket, hogy keressük az mtCNPáz-interaktív fehérjéket az érintkezési helyeken belül, ahol az mPTP komplex található. Az ANT-t és a feszültségfüggő anioncsatornát (VDAC) korábban az mPTP komplexum összetevőinek tekintették. A genetikai vizsgálatok azonban azt sugallják, hogy az mPTP összetételéhez nincs szükség VDAC-ra és ANT-ra [27,28], mégis a VDAC-t és az ANT-t továbbra is az mPTP szabályozóinak/modulátorainak tekintik [29,30,31]. A ciklofilin D (CyP-D) azonban egy mitokondriális mátrixfehérje, amelyet az mPTP működésének egyik kritikus elemének tekintenek [32]. Kimutatták, hogy az mtCNPáz együtt kicsapódott bázikus mPTP szabályozókkal, mint például CyP-D, VDAC és ANT [33]. Annak megállapítása, hogy az mtCNPase együtt lokalizálódik a CyP-D-vel, az ANT-vel és a VDAC-val, valamint az α-tubulinnal Ca2 + -terhelt és terheletlen mitokondriumokban, jelzi ezen fehérjék közötti lehetséges fizikai kötődést a mitokondriumokban.
Az mtCNPase szerepének sematikus ábrázolása az mPTP funkcióban.
A külső mitokondriális membránban az mtCNPáz kölcsönhatásba léphet a VDAC-szal, amely a fő külső membránfehérje, amely részt vesz a külső mitokondriális membrán permeabilitásában. A VDAC lehet nyitott vagy zárt állapotban. Zárt VDAC állapotban csatornája átjárhatóbb a Ca 2+ számára [34], így az mPTP megnyílásának gyorsulása következhet be, és az α-tubulin kötődése a VDAC-hoz megkönnyíti annak bezáródását [35]. Mivel mind a VDAC, mind az mtCNPáz az α-tubulinhoz kötődik, a VDAC vezetőképességét közvetlenül mtCNPáz vagy α-tubulin kötés szabályozhatja, lehetővé téve a külső membrán permeabilitásának modulálását.
Az mtCNPáz társulása az I, V, III és II komplexekkel Ca 2+ -terhelt RBM-ben azt mutatta, hogy az mtCNPáz szabad formában létezhet, és felszabadulhat a mitokondriumokból, citokróm c-vel és más apoptotikus faktorokkal együtt. Az mPTP megnyitása megkönnyítette az mtCNPase felszabadulását az RBM-ből, hasonlóan a citokróm c, AIF és Endo G felszabaduláshoz. Ezenkívül Ca 2+ -terhelési körülmények között a 2 ′, 3′-cAMP elősegíti az mtCNPáz, az AIF és az Endo G felülszabályozott felszabadulását, bár nem változtatta meg a citokróm c felszabadulást. Az mtCNPase és az AIF felszabadulása és az Endo G közötti összefüggés jelzi az mtCNPase és az apoptózis kaszpázfüggetlen útvonalának lehetséges kapcsolódását [33].
4. Az mtCNPáz bevonása a Ca 2+ által indukált mPTP nyitás szabályozásába
Asztal 1
A CNPáz leütésének hatása a mitokondriális funkcionális paraméterekre Ca 2+ által kiváltott mPTP nyitáskor.
A Ca 2+ beáramlási sebesség relatív értékei A késleltetési idő relatív értékei A Ca 2+ kapacitás relatív értékei| Vad típus | 1,00 ± 0,11 | 1,00 ± 0,06 | 1,00 ± 0,14 |
| Összekapcsolt siRNS | 0,97 ± 0,10 | 0,85 ± 0,08 | 0,98 ± 0,05 |
| CNPáz siRNS | 0,87 ± 0,13 | 0,66 ± 0,09 ** | 0,68 ± 0,11 * |
* p 2+ beáramlási sebességet figyeltek meg a különféle sejttípusokból izolált mitokondriumokban. Csökkent Ca 2+ -kapacitást (kb. 30%) és lag-fázist (kb. 40%) találtak a CNPáz leütéses mitokondriumai esetében [16]. Tehát az mtCNPáz fehérje szintje a mitokondriumokban fontosnak tűnik a Ca 2+ által kiváltott mPTP fejlődés szabályozásában.
A CNPáz 2 ’, 3’-ciklikus nukleotidokat hidrolizál a megfelelő monofoszfátokká [1]. A CNPáz szubsztrátok, a 2 ′, 3′-ciklikus nukleotidok mitokondriális működésére gyakorolt hatásáról szintén beszámoltunk [16]. A 2 ′, 3′-cAMP és 2 ′, 3′-cNADP szignifikánsan fokozta az mPTP Ca 2+ által kiváltott nyitását. Ezt a hatást a Ca 2+ transzport, a membránpotenciál disszipációja és az RBM duzzanata esetén figyelték meg. Mindkét CNPáz szubsztrát képes volt csökkenteni a lagfázist és növelni a Ca 2+ kiáramlásának sebességét az RBM-ből a Ca 2+ által kiváltott mPTP-nyitás alatt [16]. Az mtCNPáz enzimatikus aktivitása a Ca 2+ által indukált mPTP nyitás alatt csökkent és megakadályozták a 2 ’, 3’-ciklikus nukleotidok hidrolízisét [16]. Következésképpen a 2 ′, 3′-cAMP és 2 ′, 3′-cNADP akciók hatékonysága nőtt az mPTP nyitásának stimulálása Ca 2+ -indukcióval a visszacsatolási hurokban (2. ábra). Ezért azt javasolták, hogy élő sejtekben az mtCNPáz aktivitás gátlása a Ca 2+ által kiváltott mPTP megnyílása alatt a mitokondriumokban hozzájárul a 2 ', 3′-ciklikus nukleotidszintek emelkedéséhez. Így úgy tűnik, hogy a CNPase szubsztrátok, mint a 2 ′, 3′-cAMP, második hírvivőként működnek, elősegítve a mitokondriális mPTP megnyitását.
5. CNPáz a patológiában és az öregedésben
5.1. CNPase a patológiában és az öregedésben
A megnövekedett kognitív deficit, amely összefüggésbe hozható a mielin idegrostok sérülékenységével, normális öregedéssel fordul elő. Az is ismert, hogy az agy öregedésével korfüggő változások következnek be a legfontosabb mielinfehérjékben, beleértve a CNPázt is. Ez különösen a kognitív funkció károsodásához vezet [50]. Az idegrostok elvesztése és a mielin szerkezetének megváltozása az idegsejtek hatástalan vezetéséhez vezet az öregedés során. A CNPáz, az egyik leggyakoribb mielin fehérje, fontos szerepet játszhat a mielin és az axon integritásának fenntartásában az életkor előrehaladtával [51].
Az előző megbeszélés csak a mielinnel társult CNPáz részvételére vonatkozott az öregedés és a központi idegrendszer patológiáinak hátterében álló mechanizmusokban. Az utóbbi években azonban számos tanulmány jelent meg, amelyek azt mutatják, hogy a myelinizálatlan szövetekben és sejtekben jelen lévő CNPáz fontos szerepet játszik a különféle betegségek patogenezisében is, különösen a mitokondriumon keresztül, amelyet a következő szakasz tárgyal.
5.2. mtCNPase az öregedésben
A CNPáz szerepe a mitokondriumokban az öregedésben.
5.3. CNPáz és rák
Mint korábban említettük, a CNPáz részt vesz az idegsejtek gyulladásának kialakulásában [45], a krónikus fertőzéseket és gyulladásokat a rák kialakulásának kockázati tényezőinek tekintik [57]. Másrészt az mtCNPase részt vesz az mPTP működésében, és így feltételezik, hogy szerepet játszik az apoptózisban [16]; ezért érdekes lenne felmérni, hogy ez a fehérje milyen szerepet játszik a különböző daganatok kialakulásában.
Egy másik tanulmányban felfigyeltek a CNPáz fokozott expressziójára az akut myeloid leukémia HL-60 sejtekben retinsav jelenlétében, amely egy ilyen típusú rák kezelésében használt szer [61]. Ezenkívül korrelációt találtak a mitokondriális membránok alkotóelemeinek, valamint az mPTP, a VDAC és a transzlokátor fehérje (TSPO) szabályozóinak más fehérjék csökkent expressziójával [61]. A TSPO-ról beszámoltak a különböző típusú daganatok, köztük az agydaganatok és a gliomák növekedéséről [63,64,65]. Más jelentések szerint a TSPO kulcsfontosságú szerepet játszik a rákos daganatok kialakulásában [63,66,67,68]. Az mtCNPase és a TSPO expressziós szintjei közötti megfigyelt összefüggés közös mechanizmusra utal a karcinogenezisben.
5.4. mtCNPase és akut szívelégtelenség
Mivel a mitokondrium a legfontosabb normális szerv a szív normális működéséhez, a mitokondrium funkcionális állapotának megzavarása gyakori oka a szív- és érrendszeri rendellenességek kialakulásának [71]. Az ATP termelés, a Ca 2+ homeosztázis fenntartása és a belső és külső mitokondriális membránok permeabilitása a mitokondriális funkció legfontosabb jellemzői; ezért ezeknek a folyamatoknak a zavarai patológiákhoz vezethetnek. A metabolikus szívbetegségekben tehát a mitokondriumokban az ATP szintézisében bekövetkezett rendellenességet figyeltek meg, amelyet a kalcium transzportjának változásai közvetítettek. A metabolikus szívbetegségekben megfigyelték az ATP és a szívizom retractile raktárának csökkent termelését [72]. A mitokondriális Ca 2+ elengedhetetlen a ROS termeléséhez és az mPTP működéséhez is. Mind az iszkémia/reperfúzió, mind a szívelégtelenség folyamataiban ezek a tényezők részt vesznek [73,74,75].
A sejthalál a mitokondriális belső gyilkossági mechanizmusok, a nekrózis és az apoptózis következtében kialakuló zavarok után számos szívbetegség hátterében áll [76]. A membránok permeabilitásának szabályozásával a mitokondrium szabályozza a nekrotikus és apoptotikus szívizomsejtek pusztulását [77]. Így a külső membránok permeabilizációja a Bcl-2 család fehérjéivel és a belső membrán permeabilitásának mPTP-szabályozása központi eseménynek tekinthető a nekrózisban és az apoptózisban [77]. Az mPTP szerepét számos szív- és érrendszeri betegségben széles körben megvitatták [78,79,80,81,82]. A bizonyítékok arra utalnak, hogy az mPTP közvetlenül vagy közvetve részt vesz a kardioprotektív jelátviteli utakban. Így az mPTP ígéretes gyógyszercélpont lett a terápiás megközelítésekben. A sok éves kutatás ellenére azonban a folyamat bonyolultsága elakasztotta a kutatókat, és a szívben az mPTP molekuláris azonossága és szabályozási mechanizmusa még mindig nem világos.
Ezenkívül megvizsgálták az asztaxantin (AST) hatását a mitokondriális funkció paramétereire. Az AST, mint antioxidáns, gyulladáscsökkentő tulajdonságokkal rendelkezik, és számos szívbetegség terápiás szereként képes. Az AST egy xantofill-karotinoid, vörös pigment, amely a tengeri állatoknak, például a lazacnak, a pisztrángnak, a ráknak és a homárnak jellegzetes vöröses színüket adja [92]. Vannak olyan növények, algák és mikroorganizmusok, amelyek nagy koncentrációban tartalmaznak ilyen karotinoidokat, amelyek meglehetősen mindenütt jelen vannak. Az emberek nem tudják szintetizálni őket, ezért szükségük van rá, hogy táplálékukba bevegyék őket [93]. Az AST két oxigénezett csoportot tartalmaz két gyűrűszerkezeten, ami meghatározza fokozott antioxidáns képességeit [94]. A homocisztein által kiváltott kardiotoxicitás modelljében az AST képes volt helyreállítani a mitokondriumok integritását és gátolni a mitokondrium által közvetített apoptózist [95,96]. Az AST hozzáadása megakadályozta az mPTP megnyílását, és ezáltal javította a mitokondriális funkciót és csökkentette a mitokondriumok stresszérzékenységét.
Felvetődött, hogy az mtCNPase védő funkciót tölt be, és célpontja lehet az AST hatásának az RHM-ben. Ezt a hipotézist a jövőben akut szívelégtelenségben szenvedő patkányokon végzett AST krónikus alkalmazásának kísérleteiben fogják igazolni. Mindazonáltal az AST hatékony gyógyszerként tekinthető a szívműködés javítására normál és kóros körülmények között, és molekuláris célpontja az mtCNPáz. A 4. ábra összefoglalja az mtCNPase szerepét az akut szívelégtelenség kialakulásában.
- A 2 ′, 3 ′ - 3 ′ - ciklikus nukleotid - foszfodiészteráz aktivitása patkányszövetekben - Weissbarth - 1982 -
- A Cyclorana australis fosszoriális béka gubója elsősorban a víz gátjaként funkcionál
- A legjobb Quadriceps Exercise edzések és funkciók
- A pozitív megerősítések ereje megváltoztathatja az életedet
- Súlycsökkentés és kardiovaszkuláris előnyök